
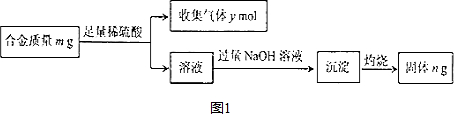
分析 (1)30.00mL 5.00mol•L-1的稀硫酸如果溶解的全部是碳酸镁,则其质量为最少,根据硫酸与碳酸镁反应的方程式可计算出原料的质量;
(2)加入H2O2的目的是将溶液中的亚铁离子氧化成铁离子再调节pH值,将铁元素除去,据此书写离子方程式;
(3)根据Ksp[Mg(OH)2]可计算出镁离子开始出现沉淀时的pH值,根据Ksp[Fe(OH)3]可计算出铁离子沉淀完全时的pH值,据此判断溶液的pH值范围;
(4)在pH在9~10之间溶液A中,可以通过锌离子的物质的量计算出剩余EDTA的物质的量,调节pH在5~6时,通过锌离子的物质的量可计算出总EDTA的物质的量,由此可计算出与镁离子反应的EDTA的物质的量,根据$\frac{镁离子的质量}{样品的质量}$×100%计算出Mg2+的质量分数;
解答 解:(1)30.00mL 5.00mol•L-1的稀硫酸的物质的量为0.15mol,根据硫酸与碳酸镁反应的方程式可知碳酸镁的物质的量也为0.15mol,所以碳酸镁的质量为0.15mol×84g/mol=12.60g,
故答案为:12.60g;
(2)加入H2O2的目的是将溶液中的亚铁离子氧化成铁离子再调节pH值,将铁元素除去,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根据Ksp[Mg(OH)2]可知镁离子开始出现沉淀时溶液中氢氧根离子的浓度为$\sqrt{\frac{1.0×10{\;}^{-12}}{0.01}}$mol•L-1=1×10-5 mol•L-1,此时溶液的pH值为9,根据Ksp[Fe(OH)3]可知铁离子沉淀完全时溶液中氢氧根离子的浓度为$\root{3}{\frac{1.0×10{\;}^{-39}}{1×10{\;}^{-6}}}$mol•L-1=1×10-11mol•L-1,此时溶液的pH值为3,所以需调节溶液pH范围为3~9,
故答案为:3~9;
(4)Mg2+、Zn2+与EDTA均按1:1反应,在25mL溶液A中:n(EDTA)=n(Zn2+)=0.10×20.00×10-3=2.00×10-3mol,
则100mL溶液A中剩余EDTA的量:n(EDTA)=2.00×10-3×100/25=8.00×10-3mol
25mL溶液A中EDTA的量:n(EDTA)总=n(Zn2+)=0.10×30.00×10-3=3.00×10-3mol
则100mL溶液A中EDTA总量:n(EDTA)总=3.00×10-3×4=0.0120mol
所以与1.5g样品中镁离子反应的EDTA的物质的量为0.012mol-8.00×10-3 mol=0.004mol,所以样品中n(Mg2+)=0.004mol,其质量为0.004mol×24g/mol=0.096g,
则该结晶硫酸镁中Mg2+的质量分数为$\frac{0.096g}{1.5g}$×100%=6.4%,
故答案为:6.4%.
点评 本题考查了物质的制备、分离提纯实验方案的设计,注意把握习题中的信息、物质的性质及混合物分离方法为解答的关键,侧重分析与实验能力、以及计算能力的考查,题目难度中等.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| B. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| C. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>A | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | 最髙价氧化物对应水化物的碱性:C<D | |
| D. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷在浓硫酸加热条件下可制得乙烯 | |
| B. | 一定条件下,所有的醇均能发生脱水反应形式碳碳双键或碳碳叁键 | |
| C. | 石油的裂化、裂解,煤的气化、液化都是化学变化 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3,3-二乙基戊烷;
3,3-二乙基戊烷; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是良好的半导体材料 | |
| B. | 氨气与硝酸合成氮肥属于人工固氮 | |
| C. | 金刚石、石墨和富勒烯互为同素异形体 | |
| D. | 硬铝、青铜和不锈钢都属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入四氯化碳,操作振荡、静置, 现象CCl4层呈橙红色,水层呈无色 | 假设1正确 |
| ②向溶液中另入KSCN溶液, 现象溶液变为红色 | 假设2正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com