
下列关于金属保护的说法不正确的是

A. 图1是牺牲阳极阴极保护法,图2是外加电流阴极保护法
B. 两种保护法共同点是被保护的钢闸门上均为电子流出
C. 图1中的负极反应是Zn-2e-=Zn2+
D. 图2中钢闸门表面发生还原反应
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是( )
A、强碱性溶液中:K+、Al3+、Cl-、
B、含有0.1 mol·L-1Fe3+的溶液中:K+、Mg2+、I-、
C、含有0.1 mol·L-1Ca2+的溶液中:Na+、K+、 、Cl-
、Cl-
D、室温下,pH=1的溶液中:Na+、Fe3+、 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:

已知以下信息:
 | |||
 | |||
① 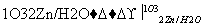 R1CHO+
R1CHO+
②1 mol B经上述反应可生成2 mol C,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢
 |
⑤ +H2O
回答下列问题:
(1)由A生成B的化学方程式为__________________,反应类型为________________。
(2)D的化学名称是________,由D生成E的化学方程式为________________________________________________________________________。
(3)G的结构简式为______________________________________________。
(4)F的同分异构体中含有苯环的还有________种(不考虑立体结构),其中核磁共振氢谱为4组峰,且面积比为6∶2∶2∶1的是____________(写出其中一种的结构简式)。
(5)由苯及化合物C经如下步骤可合成N异丙基苯胺。
 |
N异丙基苯胺
反应条件1所选用的试剂为________________,反应条件2所选用的试剂为______________,Ⅰ的结构简式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化不能说明发生了化学变化的是
A. 变化时有电子的得失或共用电子对的形成
B. 变化过程中有旧化学键的断裂和新化学键形成
C. 变化前后原子的种类和数目没有改变,分子种类增加了
D. 变化时释放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:

下列说法正确的是
A. T1<T2,且该反应为吸热反应
B. x=2
C. 若平衡后保持温度不变,改变容器体积平衡不移动
D. T1℃下,若起始时向甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一部分氧化的Na2SO3样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A. 将样品配制成溶液V1L,取其中25.00 mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2 mL
B. 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为b g
C. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D. 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g
查看答案和解析>>
科目:高中化学 来源: 题型:
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
查阅资料:①MnCO3难溶于水,潮湿时易被空气氧化,100℃开始分解。
②Mn(OH)2开始沉淀时pH=7.7。
实验过程:
Ⅰ. 用图1所示装置制备MnSO4溶液。
Ⅱ. 边搅拌边向MnSO4溶液中加入稍过量NaHCO3溶液,过滤。
Ⅲ. 洗涤沉淀。
Ⅳ. 洗涤后的沉淀在温度低于100℃的条件下干燥,制得高纯MnCO3固体。
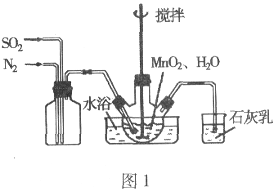
(1)图1中石灰乳的作用是__________,烧瓶中发生反应的化学方程式是__________。
(2)根据图2“浸锰”的反应适宜时间是____________________。若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图3。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是______________________________。

图2 图3
(3)Ⅱ中加入稍过量NaHCO3溶液,控制溶液pH在__________范围,写出加入NaHCO3,后发生反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关氨气的实验较多,下面对这些实验原理的分析中,正确的是( )
A、氨气极易溶于水,可以用来做喷泉实验
B、氨气的还原性可以解释氨气与氯化氢的反应实验
C、NH3·H2O不稳定,实验室可用NH4Cl和石灰水制取氨气
D、NH3液化时放出大量的热,因而,不能用氨作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
向恒温、恒容(2L)的密闭容器中充入2molX和一定量的Y,发生反应:2X(g)+Y(g) 2Z(g)
2Z(g)
ΔH<0,4min后达到平衡c(X)=0.2mol·L-1,且X与Y的转化率相等。下列说法中不正确的是( )
A.达到平衡时,再充入1molX,反应的焓变保持不变
B.用Y表示4min内的反应速率为0.1 mol·L-1·min-1
C.再向容器中充入1molZ,达到新平衡,c(X)∶c(Y)=2∶1
D.4min后,若升高温度,平衡常数K增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com