(2010?娄底模拟)已知物质M由X、Y两种短周期元素且同周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的最低负价代数和为6.M与其它物质的转化关系如图1(部分产物已略去)
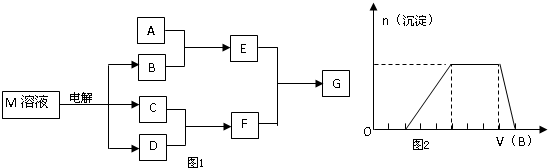
(1)若A是X、Y同周期元素的一种单质,当F的水溶液过量时,G为可溶性盐,当F的水溶液不足时,G为沉淀,则E与过量F溶液反应的离子方程式是
AlO2-+4H+═Al3++2H2O
AlO2-+4H+═Al3++2H2O
.
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则A与B反应的化学方程式是
SiO2+2NaOH═Na2SiO3+H2O
SiO2+2NaOH═Na2SiO3+H2O
.
(3)若A是一种常见化肥,其水溶液呈酸性,且E与F反应生成G时有白烟产生,则溶液中A与B加热时反应的离子方程式是
.
(4)若A是一种溶液,只可能含有H
+、NH
4+、Mg
2+、Fe
3+、Al
3+、CO
32-、SO
42-中的某些离子,当向该溶液中加入B溶液时,发现生成沉淀的物质的量随B溶液的体积变化如图2所示,由此可知,该溶液中肯定含有
的阳离子是
H+、NH4+、Al3+
H+、NH4+、Al3+
,且各阳离子的物质的量之比为
2:3:1
2:3:1
.




 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案