
分析 (1)据硫酸铝与硫酸铵和水反应生成铵明矾来书写方程式;
(2)①据n=$\frac{m}{M}$得到铵明矾的物质的量,并据1NH4Al(SO4)2•12H2O~5NaOH,求NaOH的相关的量;
②据NaOH显碱性分析;
③据NH+4+OH-=NH3↑+H2O;NaAlO2和少量的CO2的反应来书写离子方程式;
④据Ba2++SO42-=BaSO4↓进行分析.
解答 解:(1)硫酸铝与硫酸铵和水反应生成铵明矾,方程式为Al2(SO4)3+(NH4)2SO4 +12H2O=2NH4Al(SO4)2•12H2O,
故答案为:Al2(SO4)3+(NH4)2SO4 +12H2O=2NH4Al(SO4)2•12H2O;
(2)①n(铵明矾)=$\frac{m}{M}$=$\frac{45.3g}{453g/mol}$=0.1mol,
1NH4Al(SO4)2•12H2O~5NaOH
1 5
0.1×$\frac{25ml}{1000ml}$ 0.5×$\frac{25ml}{1000ml}$
则:n(NaOH)=0.5×$\frac{25ml}{1000ml}$ mol=xmol•L-1×0.025L,解得x=0.5mol•L-1,
故答案为:0.5;
②NaOH显碱性,故用碱式滴定管,故答案为:碱式滴定管;
③NH+4+OH-=NH3↑+H2O,故可得到NH3;向NaAlO2溶液中通入少量CO2,反应生成碳酸钠和氢氧化铝沉淀,正确的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故NaAlO2溶液中通入少量SO2,反应生成碳酸钠和氢氧化铝沉淀,故离子方程式为2AlO2-+SO2+3H2O=2Al(OH)3↓+SO32-,
故答案为:NH3;2AlO2-+SO2+3H2O=2Al(OH)3↓+SO32-;
④Ba2++SO42-=BaSO4↓,NH4Al(SO4)2•12H2O~2SO42-
故:NH4Al(SO4)2•12H2O~2BaSO4
1 446
0.1×$\frac{25ml}{1000ml}$ 1.165
则:m(BaSO4)=1.165g,故答案为:1.165.
点评 本题主要考查的是无机非金属材料的流程与应用,属于中等题,考查的是学生综合分析问题的能力.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
 下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题:
下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题: .
. ,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.
,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1的AlC13溶液中含有Al3+的数目小于2NA | |
| B. | 用石灰乳完全吸收1 molCl2时,转移的电子数为2 NA | |
| C. | 标准状况下,1 mol CH3Cl中含有的共价键数目为4 NA | |
| D. | 标准状况下,分子数均为NA 的O2与NO混合后,气体的体积约为44.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:13 | B. | 5:7 | C. | 4:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| B. | 改变温度,产物中NaClO3的最大理论产量为$\frac{1}{7}$amol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:$\frac{1}{2}$amol≤n≤$\frac{5}{6}$amol | |
| D. | 某温度下,若反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(C{l}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{11}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
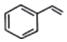 )的说法错误的是( )
)的说法错误的是( )| A. | 苯乙烯与乙烯互为同系物 | B. | 所有原子可能在同一平面 | ||
| C. | 可使酸性KMnO4溶液褪色 | D. | 可发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放人生石灰 | |
| B. | 地沟油可以用来制肥皂、提取甘油或者生产生物柴油 | |
| C. | 航天飞船中使用的碳纤维.是一种新型无机非金属材料 | |
| D. | 汽车排放的尾气和冬季取暖排放的顆粒污染物是形成雾霾的一个因素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com