
| A、甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ?mol-1 |
| B、已知:S(s)+O2(g)=SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
| C、2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ?mol-1 |
| D、△H>0的化学反应在高温条件下才能自发进行 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、c为粗铜板、d为纯铜板 |
| B、电解过程中,SO42-浓度几乎不变 |
| C、电解过程中,阳极质量的减少与阴极质量的增加相等 |
| D、电解过程中,c电极板附近沉积不溶物,d电极板质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子数 | B、分子数 |
| C、质量 | D、密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、CO的燃烧热为283 kJ/mol |
| B、二氧化碳分解为一氧化碳和氧气的反应是吸热反应 |
| C、△H3=△H2-△H1=110.5 kJ/mol |
| D、△H3=△H1-△H2=-110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
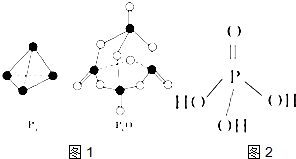 第五主族的磷单质及其化合物在工业上有广泛应用.
第五主族的磷单质及其化合物在工业上有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:
 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com