
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是

A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
【答案】D
【解析】
A、根据图中曲线x的数据知pAg=-lgc(Ag+)=6,c(Ag+)=10-6mol/L,pX=-lg c(Xn-)=0,则c(Cl-)=1mol/L,Ksp(AgCl)= 10-6,与表中数据不符,选项A错误;
B、析出沉淀时,AgCl溶液中c(Ag+)= =
=![]() mol/L,Ag2CrO4溶液中c(Ag+)=
mol/L,Ag2CrO4溶液中c(Ag+)= =
=![]() mol/L,c(Ag+)越小,先生成沉淀,则首先产生白色沉淀,选项B错误;
mol/L,c(Ag+)越小,先生成沉淀,则首先产生白色沉淀,选项B错误;
C、298K时若增大p点的阴离子浓度,由图可知,若沿曲线向上移动,c(Ag+)减小,选项C错误;
D、298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=
2AgSCN(s)+CrO42- (aq)的平衡常数K=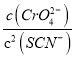 =
= =
= =
=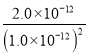 =2.0×1012,选项D正确。
=2.0×1012,选项D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】下列关于乙醇的说法正确的是( )
A. 通过加成反应可制取乙酸乙酯B. 可用淀粉水解产物来制取
C. 与乙醚互为同分异构体D. 乙醇不能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为_____。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为____(填化学式)。
(3)元素①、③形成的18电子化合物的电子式为____,元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式)。
(4)元素②、⑤形成化合物的电子式为_____。
(5)元素⑤的最高价氧化物对应的水化物的水溶液与元素⑧的最高价氧化物对应水化物反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有化合物
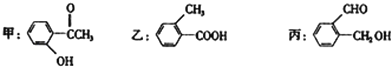
(1)请写出甲中含氧官能团的名称:________
(2)请判别上述哪些化合物互为同分异构体:_______
(3)甲、乙、丙三种物质中,遇FeCl3溶液显紫色的是_____(填“甲”“乙”或“丙”,下同),能与银氨溶液发生银镜反应的是_____,能与碳酸钠溶液反应放出CO2气体的是_____
(4)请按酸性由强至弱排列甲、乙、丙的顺序:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。气体X和液体Y不可能是( )
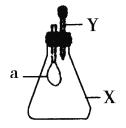
A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1998年,中国科学家便成功地在较低温度下制造出金刚石:CCl4+4Na![]() C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
(1)Ni原子价层电子的排布式为_______。元素C、Cl、Na中,第一电离能最大的是______________。
(2)石墨在高温高压下也可转变为金刚石。在石墨和金刚石中,C原子的杂化类型分别为_____________,熔点较高的是_____________,其原因为_______________。
(3)NH3易与Ni形成配合物 [Ni(NH3)6]SO4,该配合物中存在的化学键类型有_____________,其阴离子的空间构型为_____________。
(4)金属间化合物MgCNi3是一种新型超导体,呈钙钛矿构型,X射线衍射实验测得其晶胞参数为a=0.3812nm,其晶胞结构如图所示。晶胞中C位于Ni所形成的正八面体的体心,该正八面体的边长为___________nm。(![]() =1.414)
=1.414)
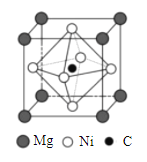
(5)在MgCNi3晶胞结构的另一种表示中,Mg处于体心位置,则C处于________________位置,Ni处于_______________位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学知识解答问题:
(1)微粒![]() 中的质子数是_____,中子数是_____,核外电子数是_____。
中的质子数是_____,中子数是_____,核外电子数是_____。
(2)写出氯离子的原子结构示意图__,写出氯化钠的电子式___,用电子式表示HCl的形成过程___。
(3)NH4NO3是___化合物(填“离子”或“共价”),NaOH所含化学键类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为____________,形成该分散系的微粒直径范围是_________。
(3)电子工业需用30%FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式_________。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气、②铁粉、③浓硝酸、④浓盐酸、⑤烧碱、⑥浓氨水,需用用到的一组试剂是__________。
A. ①②④ B. ①③④⑥ C. ②④⑤ D. ①④⑥
(4)高铁酸钠Na2FeO3是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为__________。
②高铁酸钠在水中可以发生如下反应:FeO42-+10H2O=4Fe(OH)3+8OH-+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有_____性,而能够除去水中悬浮物是因为________。
③下列物质能作净水削的有_________。
a.KAl(SO4)2·12H2O b.聚合硫酸铁[Fe(OH)(SO4)]n c.ClO2 d.“84消毒液”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com