
| A. | 10:1 | B. | 1:10 | C. | 1:2 | D. | 2:1 |
分析 pH=2的H2SO4溶液中c(H+)=10-2mol/L,pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,混和液pH=7,则n(H+)=n(OH-),再结合n=cV列式计算.
解答 解:pH=2的H2SO4溶液中c(H+)=10-2mol/L,
pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,
混和液pH=7,说明两溶液恰好中和,则n(H+)=n(OH-),
即:V[H2SO4(aq)]•c(H+)=V[NaOH(aq)]•c(OH-),
所以V[H2SO4(aq)]:V[NaOH(aq)]=c(OH-):c(H+)=10-3mol/L:10-2mol/L=1:10.
故选B.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


科目:高中化学 来源: 题型:实验题
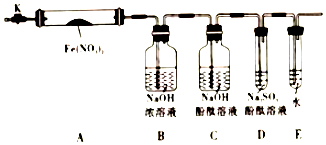 固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
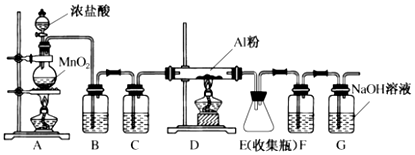
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的Ksp=6.82×l0-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |
| B. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生反应的离子方程式:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O | |
| C. | 将表中3种物质与水混合,加热蒸干、灼烧,最终的固体产物不相同 | |
| D. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与氧气反应,条件不同产物不同 | |
| B. | 金属钠着火可用水扑灭 | |
| C. | 少量的钠可保存在汽油里 | |
| D. | 钠的化学性质活泼,可从硫酸铜溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2 (g)+O2 (g)?2NO(g) | 工业固氮 N2 (g)+3H2 (g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
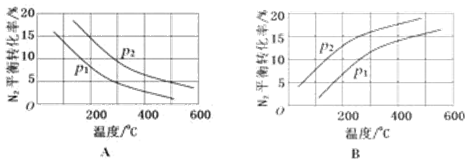
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
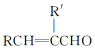 +H2O
+H2O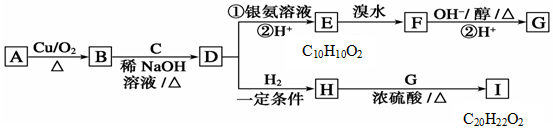
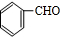 ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基.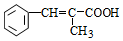 +
+ $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$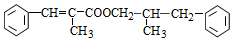 +H2O.
+H2O.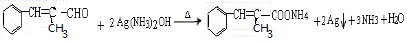 .
.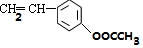 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com