
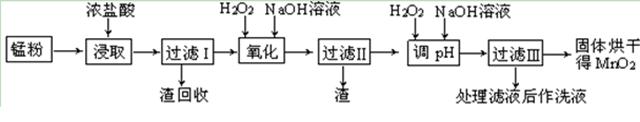
| �� �� | ��ʼ���� | ������ȫ |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
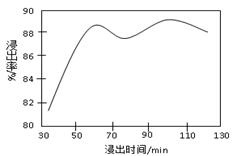


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ⷨ������ͭ���ô�ͭ������ |
| B��������ڵ��Ȼ�����ȡ�����ƣ����������� |
| C���ڶƼ��ϵ��п����п������ |
| D����ⱥ��ʳ��ˮ���ռ��Ϳ��̼���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Cu2++H2��,�����й��ڸ�װ�õ��й�˵������ȷ����(����)
Cu2++H2��,�����й��ڸ�װ�õ��й�˵������ȷ����(����)| A����װ�ÿ�����ԭ���,Ҳ�����ǵ��� |
| B����װ��ֻ����ԭ���,�ҵ������ҺΪ���� |
| C����װ��ֻ���ǵ���,�ҽ���ͭΪ�õ��ص����� |
| D����װ��ֻ����ԭ���,�������Һ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
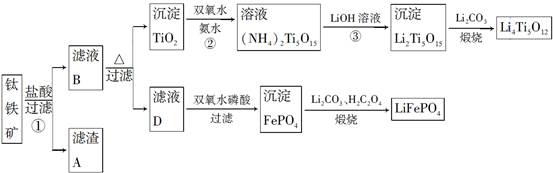
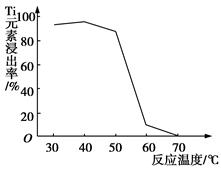
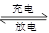 Li7Ti5O12��3FePO4���õ�س��ʱ������Ӧʽ��____________________��
Li7Ti5O12��3FePO4���õ�س��ʱ������Ӧʽ��____________________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
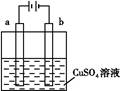
| A����a��bΪʯī,ͨ���a�缫�Ϸ����ķ�ӦΪCu2++2e-=Cu |
| B����a��bΪʯī,ͨ�������̪,a�缫������Һ�ʺ�ɫ |
| C����aΪͭ,bΪ��,ͨ���Cu2+��a�缫�ƶ� |
| D����aΪ��ͭ,bΪ��ͭ,ͨ���b�缫�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ס������ձ�����Һ��pH�����ֲ��� |
| B�����ձ���a�ĵ缫��ӦʽΪ��4OH�D�D4e- = O2����2H2O |
| C�������һ��ʱ����ס�������Һ��ϣ�һ���������ɫ���� |
| D����b������3.2gʱ��d������������Ϊ2.24L����״���£� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

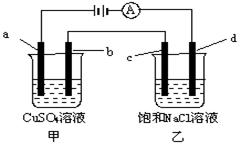
| A��a�缫һ�����������Һc������CuCl2��Һ |
| B�����һ��ʱ�䣬b�缫����pH���� |
| C����Һ�е���������a�缫�ƶ� |
| D���ڼ��뱽֮ǰӦ�����Һc������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
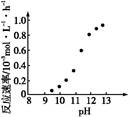
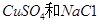 �Ļ����Һ������������Һ��pHֵ��ʱ��t�仯��ʾ��ͼ����ʾ�������ǵ����������ˮ�ķ�Ӧ�����Է���������������ȷ����
�Ļ����Һ������������Һ��pHֵ��ʱ��t�仯��ʾ��ͼ����ʾ�������ǵ����������ˮ�ķ�Ӧ�����Է���������������ȷ����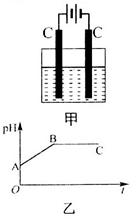
A���Ǹû����Һ�е� ������A����Һ��pHֵС��B�� ������A����Һ��pHֵС��B�� |
B��AB�߶���BC�߶��������Ϸ����ķ�Ӧ����ͬ�ļ���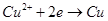 |
| C��BC�����������������������֮��Ϊ2��1 |
| D�����������Ĺ����л������������ɫ��Cu��OH��2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
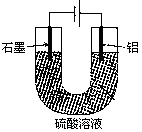
| A�������缫����ʽΪ�� Al��3e��+6OH����Al2O3+H2O |
| B�����ŵ��Ľ��У���Һ��pH������ |
| C����������������3.36L�������ʱ����������2.4g |
| D����������H+����Al�缫 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com