
分析 Na2CO3能与BaCl2反应的化学方程式:Na2CO3+BaCl2═2NaCl+BaCO3↓,NaCl、NaOH不能与BaCl2反应,得到沉淀0.197g,则碳酸钡的物质的量为:0.001mol,则碳酸钠的物质的量为:0.001mol,然后将所得滤液用0.20mol/L的盐酸标准溶液进行滴定,达到终点时消耗盐酸15.00mL,所以氢氧化钠的物质的量为:0.20mol/L×15.00mL×10-3L/mL=0.003mol,根据m=nM求各成份的质量,质量分数=$\frac{各组分的质量}{样品总质量}×100%$,进行计算求解.
解答 解:Na2CO3能与BaCl2反应的化学方程式:Na2CO3+BaCl2═2NaCl+BaCO3↓,NaCl、NaOH不能与BaCl2反应,得到沉淀0.197g,则碳酸钡的物质的量为:0.001mol,则碳酸钠的物质的量为:0.001mol,所以碳酸钠的质量为:0.001mol×106g/mol=0.106g,碳酸钠的质量分数为:$\frac{0.106g}{0.400g}×100%$=26.5%,然后将所得滤液用0.20mol/L的盐酸标准溶液进行滴定,达到终点时消耗盐酸15.00mL,所以氢氧化钠的物质的量为:0.20mol/L×15.00mL×10-3L/mL=0.003mol,所以氢氧化钠的质量分数为:$\frac{0.003×40}{0.4}×100%$=30%,所以 氯化钠的质量分数为:1-26.5%-30%=43.5%,答:Na2CO3的质量分数为26.5%,NaOH的质量分数为:30%,NaCl的质量分数为:43.5%.
点评 本题考有关混合物的计算,中等难度,计算时要搞清反应原理,充分利用质量守恒计算和物质的量为中心在解中的应用.要细心计算,容易出错.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
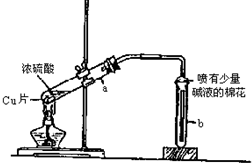 如图为浓硫酸与铜反应的实验装置图.
如图为浓硫酸与铜反应的实验装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 5:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
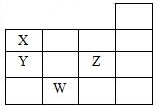 如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )
如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )| A. | 只有③ | B. | 只有①③ | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性:X>Y>Z | B. | 气态氢化物的稳定性:XH3>YH3>ZH3 | ||
| C. | 原子半径:X<Y<Z | D. | 相对原子质量:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
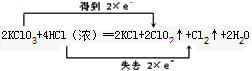 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、KOH、CsOH碱性依次增强 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次减小 | |
| D. | O22-和S2-具有相同的质子数和电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com