
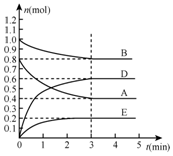
 在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).
在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).分析 (1)v=$\frac{△c}{△t}$,速率之比等于化学计量数之比;
(2)A、B减少,E、D增加,则A、B为反应物、E、D为生成物,ABDE物质的量变化量之比=(0.8-0.4):(1.0-0.8):(0.6-0):(0.2-0)=2:1:3:1,E为固体则
2A(g)+B(g)?3D(g)+E(s)
开始(mol/L) 0.4 0.5 0
转化(mol/L) 0.2 0.1 0.3
平衡(mol/L) 0.2 0.4 0.3
平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)能增大B的转化率,平衡正向移动,但不能加入B;
(4)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此解答.
解答 解:(1)根据图所示,3min反应达到平衡状态,反应开始至达到平衡时,用D表示该反应速率为$\frac{\frac{0.6mol}{2L}}{3min}$=0.1 mol/(L•min),A、B减少,E、D增加,则A、B为反应物、E、D为生成物,ABDE物质的量变化量之比=(0.8-0.4):(1.0-0.8):(0.6-0):(0.2-0)=2:1:3:1,物质的量变化量之比等于化学计量数之比,则方程式中m:n:p:q=2:1:3:1=2~1~3~1,
故答案为:0.1 mol/(L•min);2~1~3~1;
(2)A、B减少,C、D增加,则A、B为反应物、C、D为生成物,物质的量变化量之比为2:1:3:1,则
2A(g)+B(g)?3D(g)+E(s)
开始(mol/L) 0.4 0.5 0
转化(mol/L) 0.2 0.1 0.3
平衡(mol/L) 0.2 0.4 0.3
K=$\frac{0.{3}^{3}}{0.{2}^{2}×0.4}$=1.7,
故答案为:1.7;
(3)A.升高温度,平衡逆向移动,转化率减小,故A不选;
B.保持体积不变通入1molB,B的转化率减小,故B不选;
C.保持体积不变移出部分物质D(g),平衡正向移动,B的转化率增大,故C选;
D.该反应为体积不变的反应,将容器的容积增大为原来的2倍,平衡不移动,故D不选;
E.保持体积不变通入1mol A,平衡正向移动,B的转化率增大,故E选;
故答案为:C、E;
(4)A.恒容恒温时容器中气体压强始终保持不变,不能判定平衡,故A不选;
B.混合气体中D浓度不变,为平衡特征“定”,可判定,故B选;
C.v(A)正=v(A)逆,为平衡特征“等”可判定,故C选;
D.气体的质量为变量,则恒容时容器中气体密度不变,达到平衡状态,故D选;
故答案为:B、C、D.
点评 本题考查化学平衡的计算,为高频考点,把握速率及化学反应的确定,平衡三段法及K的计算、平衡移动为解答的关键,侧重分析与应用能力的考查,综合性较强,注意E为固体,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 由乙酸和乙醇生成乙酸乙酯的反应类型和由溴乙烷生成乙烯的反应类型相同 | |
| B. | 糖类、油脂和蛋白质均能发生水解反应 | |
| C. | 丙烯在一定条件下可与氯气发生取代反应生成3-氯丙烯 | |
| D. | 甲苯与氯气在光照下发生取代反应主要生成2,4二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中可以获得NaCl,NaCl是生产纯碱的原料 | |
| B. | 硅的晶体可以作为光电转换材料用于太阳能电池 | |
| C. | 明矶净水的原理和“84”消毒液的原理相同 | |
| D. | 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 澄清石灰水通入过量CO2,先有白色沉淀后沉淀消失;则向澄清石灰水通入过量SO2,也是先有白色沉淀后沉淀消失 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电浮选凝聚法是工业上的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确( )
电浮选凝聚法是工业上的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确( )| A. | 石墨电极上发生氧化反应 | |
| B. | 甲烷燃料电池中CO32-向空气一极移动 | |
| C. | 根据图示,物质A为CO2 | |
| D. | 为增强污水的导电能力,可向污水中加入适量乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铷与水反应现象与钠相似 | B. | 还原性:K>Na>Li | ||
| C. | 熔点:Li>Na>K | D. | 碱性:LiOH>NaOH>KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量卤代烃加NaOH溶液共热,冷却,再加入AgNO3溶液检验卤素原子存在 | |
| B. | 向苯酚稀溶液中滴加浓溴水观察沉淀 | |
| C. | 苯与浓溴水反应制取溴苯 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5 mol•L-1NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com