
【题目】所谓“地沟油”是从一些饭店、酒店的下水道里捞出来的残油剩渣、饭店的“泔水油”以及垃圾猪肉加工成“食用油”。制作过程:①捞去废油中的悬浮杂质;②加入双氧水进行漂白;③加入工业消泡剂(内含铅、砷等元素及苯环、杂环等化合物);④高温炼制;⑤包装成成品油出售到不法的火锅店、饭店、工厂和学校餐厅。以下判断正确的是( )
A.“地沟油”外观与普通食用油一样,经过以上处理的“地沟油”具有固定的熔沸点
B.“地沟油”可用来作化工原料,如制作肥皂等产品
C.“地沟油”在加入消泡剂后,消除对人体健康的影响
D.“地沟油”中主要成分是蛋白质,还含有较多微量元素
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。
已知①2H2(g)+O2(g)===2H2O(l)ΔH1=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)ΔH2=-192.9 kJ/mol。
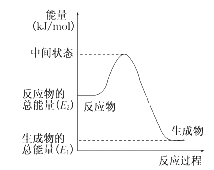
(1)甲醇蒸气完全燃烧的热化学反应方程式_______。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。
(3)H2(g)的燃烧热为________,分析H2(g)作为能源比甲醇蒸气作为能源的优点:_____(写出两点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
(1)①将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式 .
②将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: .
(2)利用如图装置可以验证非金属性的变化规律. 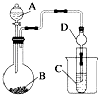
③实验室中提供药品Na2S,MnO2、浓盐酸、KMnO4 , 若要证明非金属性Cl>S;装置A,B,C中所装药品分别为 , 装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 .
④若要证明非金属性:C>Si,则A中加、B中加Na2CO3、C中加Na2SiO3 , 则观察装置C中的实验现象为有白色沉淀生成.离子方程式为 . (假设所通气体是过量的).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
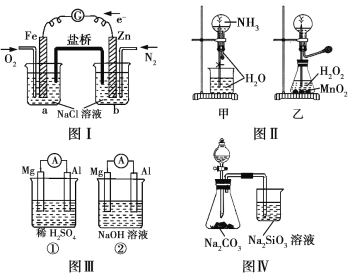
A.图Ⅰ装置中通入N2和O2的作用是相同的
B.图Ⅱ中甲、乙两装置产生喷泉的原理一样
C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极
D.图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素M的基态原子的价电子排布式:________________________。
(2)标准状况下,11.2L AC2含有π键的数目为______。写出AC2的电子式:_________________。
(3)E、F、G的第一电离能由大到小的顺序为:____________。(填元素符号)
(4)LC2I2常温下为深红色液体,能与 CCl4、CS2 等互溶,据此可判断 LC2I2是________(填“极性”或“非极性”)分子。
(5)在①苯、②CH3OH、③CS2、④C2H4、⑤CCl4五种物质中,碳原子采取sp2杂化的分子有________(填序号)。
(6)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关蛋白质的叙述,正确的是
A. 蛋白质肽链的盘曲和折叠被解开时,其特定功能并未发生改变
B. 细胞中氨基酸种类和数量相同的蛋白质是同一种蛋白质
C. 由m条肽链、n个氨基酸组成的蛋白质中至少有n+m个氧原子
D. 细胞膜上的载体蛋白是镶在细胞膜内外表面的蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若以NA代表阿伏伽德罗常数的值,下列说法中正确的是( )
A.1 mol Na 跟足量H2O反应得到电子的数目为NA
B.常温常压下,16 g甲烷(CH4)所含电子数为NA
C.标准状况下,22.4 L 酒精所含的分子数目为NA
D.常温常压下,6 g O2和26 g O3混合气体中的原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A. | 取两只试管,分别加入4 mL 0.01 mol/L KMnO4酸性溶液,然后向一只试管中加入0.1 mol/L H2C2O4溶液 2 mL,向另一只试管中加入0.1 mol/L H2C2O4溶液 4 mL,记录褪色时间 | 证明草酸浓度越大反应速率越快 |
B. | 相同温度下,测定浓度均为0.1 mol/L的Na2CO3和CH3COONa的pH,前者pH大 | 证明CH3COO结合H+的能力比 |
C. | 向1 mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3 |
D. | 向CH2=CHCHO溶液中滴入KMnO4酸性溶液 | 证明CH2=CHCHO中含有碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com