
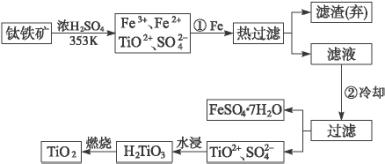
(1)Ti的原子序数为22,Ti位于元素周期表中第_____________周期,第____________族。
(2)步骤①加Fe的目的是:__________________________________________;步骤②冷却的目的是:___________________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是___________________;考虑成本和废物综合利用因素,废液中应加入________________________处理。
(4)由金红石(TiO2)制取单质Ti,涉及的步骤为:
TiO2→TiCl4![]() Ti
Ti
反应TiCl4+2Mg====2MgCl2+Ti在氩气中进行的理由是_____________________________________________________________________。
(1)4 ⅥB
(2)将Fe3+还原为Fe2+ 析出(或分离、或得到)FeSO4·7H2O
(3)FeSO4·7H2O 石灰(或碳酸钙、废碱)
(4)防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
解析:本题是一道典型的无机物框图制备题。不仅考查对基础知识的掌握,还主要考查学科知识的综合应用能力。
(1)由原子序数推断元素在周期表中的位置,关键是熟悉元素周期表的结构,即各周期起止元素的原子序数、各族的相对位置等。Ti的原子序数为22,与熟悉的Ca(原子序数为20)相近,由Ca在元素周期表中的位置,分析推断Ti位于第4周期,第ⅥB族。
(2)由框图所示流程分析可知,要将TiO2+与Fe3+、Fe2+分离,需要先加入铁粉将Fe3+还原为Fe2+,趁热过滤除去残渣,再将滤液冷却使FeSO4·7H2O析出。
(3)制备TiO2过程中的副产物FeSO4·7H2O在工农业生产和日常生活中有较多的应用。在分离出H2TiO3的废液中,还含有少量的TiO2+、Fe2+,可加入石灰(或碳酸钙、废碱)降低H+的浓度,使之转化为沉淀析出,进行循环利用。
(4)因为在高温下,Mg(Ti)与空气中的O2(或CO2、N2)作用,所以用Mg还原TiCl4时要在惰性气氛(Ar)中进行。


科目:高中化学 来源: 题型:
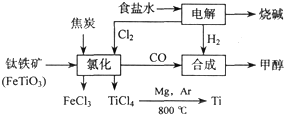
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
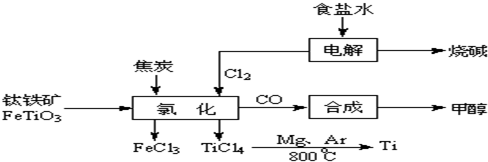
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:查看答案和解析>>
科目:高中化学 来源: 题型:
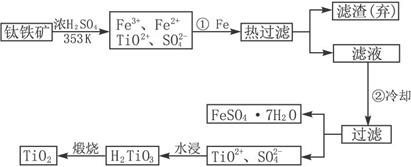
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com