

分析 含锌铜烟尘主要成分是ZnO、CuO和FeO,含锌铜烟尘经过预处理后的主要成分是ZnO,还含有少量的CuO和Fe2O3,根据物质成分差别知,预处理过程中FeO被氧化生成Fe2O3,向混合物中加入稀硫酸、锌粉,发生反应CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、ZnO+H2SO4=ZnSO4+H2O、CuSO4+Zn=Cu+ZnSO4、Fe2(SO4)3+Zn=2FeSO4+ZnSO4,分离难溶性固体和溶液采用过滤方法,所以操作a为过滤,滤渣A为Cu,向反应池中加入双氧水,反应池中的温度控制在90~95℃,反应池中所发生反应的离子方程式为:2Fe2++H2O2+4H2O═2Fe(OH)3↓+4H+,然后过滤得到沉淀B为2Fe(OH)3,向沉淀池中加入碳酸氢铵,得到aZnCO3•bZn(OH)2•cH2O沉淀,然后过滤得到沉淀和滤液A,将沉淀焙烧得到ZnO;
将滤液A蒸发浓缩、冷却结晶、过滤得到硫酸铵晶体;
(1)过滤需要的玻璃仪器有烧杯、玻璃棒和漏斗;
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:
①将Fe3+还原为Fe2+;
②置换出Cu;
③调节溶液的pH;
(3)铁离子用KSCN检验;
(4)浓硫酸吸收H2O、碱石灰吸收CO2,n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol、n(CO2)=$\frac{0.44g}{44g/mol}$=0.01mol,剩余固体为ZnO,n(ZnO)=$\frac{3.59g-0.72g-0.44g}{81g/mol}$=0.03mol,根据原子守恒得(a+b):a:(b+c)=0.03mol:0.01mol:0.04mol=3:1:4,则a:b:c=1:2:2,据此判断其化学式.
解答 解:含锌铜烟尘主要成分是ZnO、CuO和FeO,含锌铜烟尘经过预处理后的主要成分是ZnO,还含有少量的CuO和Fe2O3,根据物质成分差别知,预处理过程中FeO被氧化生成Fe2O3,向混合物中加入稀硫酸、锌粉,发生反应CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、ZnO+H2SO4=ZnSO4+H2O、CuSO4+Zn=Cu+ZnSO4、Fe2(SO4)3+Zn=2FeSO4+ZnSO4,分离难溶性固体和溶液采用过滤方法,所以操作a为过滤,滤渣A为Cu,向反应池中加入双氧水,反应池中的温度控制在90~95℃,反应池中所发生反应的离子方程式为:2Fe2++H2O2+4H2O═2Fe(OH)3↓+4H+,然后过滤得到沉淀B为2Fe(OH)3,向沉淀池中加入碳酸氢铵,得到aZnCO3•bZn(OH)2•cH2O沉淀,然后过滤得到沉淀和滤液A,将沉淀焙烧得到ZnO;
将滤液A蒸发浓缩、冷却结晶、过滤得到硫酸铵晶体;
(1)过滤需要的玻璃仪器有烧杯、玻璃棒和漏斗,故答案为:玻璃棒;漏斗;
(2)Zn的活泼性大于Cu,所以Zn置换出Cu而除去Cu2+,故答案为:除去Cu2+;
(3)铁离子用KSCN检验,其检验方法为:取样,加入几滴KSCN溶液,若溶液不出现红色,则Fe3+已经全部被还原,故答案为:取样,加入几滴KSCN溶液,若溶液不出现红色,则Fe3+已经全部被还原;
(4)浓硫酸吸收H2O、碱石灰吸收CO2,n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol、n(CO2)=$\frac{0.44g}{44g/mol}$=0.01mol,剩余固体为ZnO,n(ZnO)=$\frac{3.59g-0.72g-0.44g}{81g/mol}$=0.03mol,根据原子守恒得(a+b):a:(b+c)=0.03mol:0.01mol:0.04mol=3:1:4,则a:b:c=1:2:2,所以沉淀的组成为ZnCO3•2Zn(OH)2•2H2O,
答:沉淀的组成为ZnCO3•2Zn(OH)2•2H2O.
点评 本题考查物质分离和提纯,为高频考点,涉及基本操作、除杂、离子检验、化学式的确定等知识点,侧重考查学生分析判断及计算能力,知道常见离子的检验方法、实验现象及结论,难点是(4)题化学式的确定,利用原子守恒解答,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.2mol/(L•s) | B. | υ(B)=0.3 mol/(L•s) | C. | υ(C)=0.8 mol/(L•s) | D. | υ(D)=1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三电子层上有4个电子 | B. | 最高正价为+2 | ||
| C. | 最高正价为+4 | D. | 第二电子层没有未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
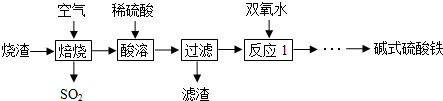
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式如图所示:
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式如图所示:
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com