
【题目】下列分散系能产生丁达尔效应的是
A. 硫酸铜溶液 B. 稀硫酸
C. 溴水 D. 氢氧化铁胶体
科目:高中化学 来源: 题型:
【题目】Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
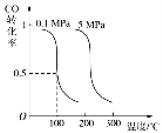
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率
(填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0. 2 mol/ L醋酸溶液,滴定曲线如图所示。
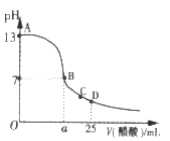
(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。
(3)在D点,溶液中离子浓度大小关系为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.要除去CO2中混有少量的SO2,可用饱和的碳酸氢钠溶液
B.SO2与Cl2混合后溶于水漂白性增强
C.因常温下铁与浓硝酸不反应,故可在常温下用铁制贮罐贮运浓硝酸
D.碱石灰和无水CaCl2都可以用于干燥NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是
A.SO2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同,但化学键种类不同
C.SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在古代,我国人民就积累了不少对化学物质变化的认识。例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书是中国为世界科技花园贡献出的一颗璀璨明珠,书中记载有“丹砂烧之成水银,积变又成丹砂”。 这句话中的丹砂指的是HgS,下列关于这句话的说法正确的是
A.这个过程只涉及物理变化 B.这个过程是可逆反应
C.这个过程发生了复分解反应 D.“丹砂烧之成水银”过程中还可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取金属镁的生产步骤有:①浓缩结晶 ②加盐酸 ③加熟石灰④过滤 ⑤熔融电解,正确的生产顺序是
A.①②③④⑤ B.②④③①⑤ C.⑤④③①② D.③④②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示转化关系(X代表卤素),说法正确的是
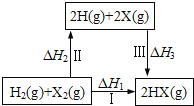
A.H2(g)+ X2(g)===2H(g)+ 2X(g) △H2>0
B.生成HX的反应热与途径有关,所以△H1≠△H2 + △H3
C.若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多
D.△H1代表H2的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回归、改进、拓展教材实验,是高考化学实验考查的常见形式。
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究。基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理。
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式__________________________________。
(2)①该催化剂中铁元素的化合价为 。
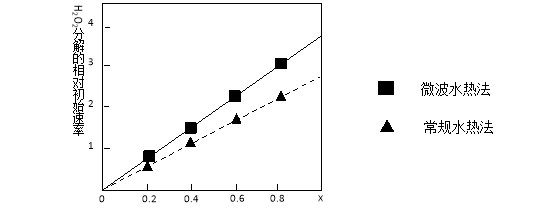
②下图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是 。
II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+ 对该反应有催化作用
假设3:K+ 对该反应有催化作用
【设计、完成实验】
(3)称取 g草酸晶体(H2C2O4·2H2O),配制500 mL 0.10 mol/L H2C2O4溶液。在上述过程中必须用到的2种定量仪器是托盘天平和
(4)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
仔细阅读分析表中数据,回答问题:
x = mL,假设__________成立(填“1” 、“2”或“3”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制乙酸乙酯的装置。
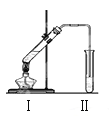
(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是 。
(2)为了证明浓硫酸的作用,某同学进行了以下4个
实验,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18molL﹣1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3molL﹣1硫酸 | 饱和Na2CO3溶液 | 1.2 |
D | 3mL乙醇、2mL乙酸、6mL6molL﹣1盐酸 | 饱和Na2CO3溶液 | 1.2 |
①为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴 试液,每次实验结束后可观察到试管Ⅱ中的现象是 ,
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是 、 ;实验D和实验C对照,你又能得出的结论是 。
(3)饱和Na2CO3溶液的作用是____________________、___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com