人类活动产生的CO
2长期积累会威胁到生态环境,其减排问题受到全世界关注.
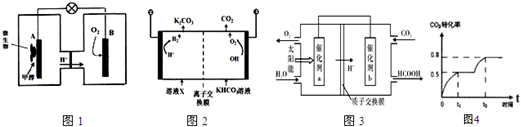
(1)微生物燃料电池是一种利用微生物将化学能直接转化为电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图1:
①A电极附近甲醇发生的电极反应式为
.
②工作结束后,B电极室溶液的pH与工作前相比将变
(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计).
(2)工业上常用高浓度的K
2CO
3溶液吸收CO
2得溶液X,再利用电解法使K
2CO
3溶液再生,其装置示意图如图2,在阳极区附近发生的反应包括
和 H
++HCO
3?═CO
2↑+H
2O
(3)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.图3是通过光电转化原理以廉价原料制备新产品的示意图.写出上述光电转化过程的化学反应方程式
.催化剂a、b之间连接导线上电子流动方向是
(填a→b或b→a).
(4)已知CO
2(g)+2CH
3OH(g)?CH
3OCOOCH
3(g)+H
2O(g)△H,控制一定条件,该反应能自发进行,即△H
0(填写>、<、=).在恒温容积可变的容器中加入1molCO
2、2mol CH
3OH,CO
2的转化率与反应时间如图4所示,在反应过程中加压.若t
1时容器体积为1000ml,则t
2时容器体积为
ml.




 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
 已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;
已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;