
 一定条件下,下列反应可为工业制盐酸、合成氨提供原料:CH4 (g)+H2O (g)?CO(g)+3H2(g)△H>0.当该反应达到平衡后,若仅改变图中x的量,重新达到平衡后,y值随x变化趋势合理的是( )
一定条件下,下列反应可为工业制盐酸、合成氨提供原料:CH4 (g)+H2O (g)?CO(g)+3H2(g)△H>0.当该反应达到平衡后,若仅改变图中x的量,重新达到平衡后,y值随x变化趋势合理的是( )| 选项 | x | y |
| A | 缩小容器体积,增大体系压强 | H2的正反应速率V正(H2) |
| B | 升高体系温度 | 容器内混合气体的平均相对分子质量 |
| C | 增大水蒸气浓度 | 达平衡时CH4的转化率 |
| D | 恒容情况下充入稀有气体进行稀释 | 该反应的逆反应常数K′ |
| A、A | B、B | C、C | D、D |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:

| A、60℃时溴酸银的Ksp约等于6×10-4 |
| B、温度升高时溴酸银溶解速度加快 |
| C、溴酸银的溶解时放热过程 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①④ | C、②③ | D、①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通人含等物质的量的FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
| B、澄清石灰水与少量的碳酸氢钠溶液反应:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| C、铜与浓硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O |
| D、硫酸氢钠溶液滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa2O2与足量的二氧化碳反应,转移电子的物质的量为2mol |
| B、等量的铝分别与足量的稀盐酸和氢氧化钠溶液反应生成氢气的质量相同 |
| C、含1mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为0.5NA |
| D、标准状况下,11.2L H2O含有0.5NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法,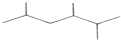 的名称为2,4,5-三甲基己烷 的名称为2,4,5-三甲基己烷 |
B、分子 中,位于同一平面上碳原子最多有6个 中,位于同一平面上碳原子最多有6个 |
C、化合物 是苯的同系物 是苯的同系物 |
| D、3-甲基-3-乙基戊烷的一氯取代产物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
| B、1mol Mg在空气中燃烧被完全氧化生成MgO和Mg3N2,失去2NA个电子 |
| C、标准状况下,22.4L苯含有1NA个苯分子 |
| D、1mol的羟基与1mol的氢氧根离子所含电子数均为9NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com