
【题目】2008年9月4日辽宁阜新市清河口区河西镇八矿,井下发生了瓦斯爆炸事故,事故共造成14人死亡,2人下落不明。实验证明,瓦斯中CH4和O2的体积比为1∶2时爆炸威力最大,则此时CH4和O2的质量比为
A.1∶1
B.1∶2
C.1∶4
D.2∶1
科目:高中化学 来源: 题型:
【题目】巴豆酸的结构简式为CH3﹣CH=CH﹣COOH.现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )
A.只有②④⑤
B.只有①③④
C.只有①②③④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明体检的血液化验单中,葡萄糖为5.9 mmol/L。表示该体检指标的物理量是( )。
A. 溶解度(s) B. 物质的量浓度(c)
C. 质量分数 D. 摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室进行氯气的制备及性质实验的组合装置,部分固定装置未画出。
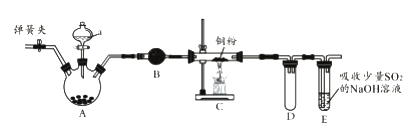
(1)A中固体是氯酸钾,液体a是浓盐酸,写出该反应的化学方程式:_________________。
(2)B为干燥装置,加入的固体是_________________;欲净化氯气,A、B间应添加一个盛有_________________的洗气瓶。
(3)C中的反应现象是_________________;D的作用是_________________。
(4)已知E中发生的反应为:Cl2+Na2SO3+2NaOH![]() 2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
a.甲同学认为该吸收液中ClO-和SO32-不能同时存在,其理由是_________________(用离子方程式表示)。
b.乙同学为了检验吸收液中是否含有SO32-,取少量吸收液于试管中,加适量稀硫酸酸化后,滴加品红溶液,发现品红溶液褪色。据此推断该吸收液中一定有SO32-。乙同学的推断是否正确?________________(填“正确”或“不正确”),理由是_________________。
c.请设计实验检验吸收液中是否含有ClO-_______________(写出实验步骤、现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
①钠、氢气都能在氯气中燃烧生成白色烟雾
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯气的水溶液,它能使干燥的有色布条褪色
④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.只有① B.①和② C.①和④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究性实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
Ⅰ、提出假设:
(1)甲同学:可能只是MgCO3;
乙同学:可能只是 ;
丙同学:可能是xMgCO3·yMg(OH)2
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,洗涤沉淀的操作方法是 。
Ⅱ、定性实验探究:
(3)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,则 同学假设错误(选填“甲”、“乙”或“丙”)。
Ⅲ、定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持类装置未画出),经实验前后对比各装置的质量变化来分析沉淀的组成,得出丙同学的假设是正确的。请回答下列问题:
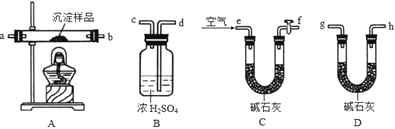
(4)实验中合理的连接顺序为:e→ → → → → → g→h(各装置只使用一次)。
(5)实验一段时间后,当B装置中 (填实验现象),停止加热,说明固体已分解完全;打开f处的活塞,缓缓通入空气数分钟的目的是 ,装置C中碱石灰的作用是 。
(6)指导老师认为在上述实验装置中末端还需再连接一个D装置,若无此装置,会使测出的x :y的值 (选填“偏大”、“偏小”或“无影响”)。
(7)若改进实验后,最终装置B质量增加m克,装置D质量增加了n克,则x :y= 。(用含m、n的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组为探究铜与稀硝酸反应产生的气体主要是NO,设计了下列实验。图中K为止水夹,F是装有一半空气的注射器,其中十加热装置和固定装置均巳略去。请回答:

(1)设置装置A的目的是 ___________;实验开始后,如何判断A的实验目的已完成
________________________________。(2)当完成装置A的实验目的后,关闭K,再将装置B中的铜丝插入稀硝酸.B中反应的离子方程式为 ____________________ 。(3)将F中的空气推入E中,证明NO存在的实验现象是 ____________________________ ,
此过程发生反应的化学方程式是 ______________________________________________ 。 (4)装置D中NaOH溶液的作用是 ________________________________________ 。
写出可能发生的一个化学方程式___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4通常用作火箭的高能燃料,N2O4作氧化剂。请回答下列问题:
(1)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+a kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-b kJ/mol
2NO2(g)N2O4(g) ΔH=-c kJ/mol
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式__________________。
(2) N2、H2合成氨气为放热反应。800 K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡。

①达到平衡时,平衡常数K甲__________K乙__________K丙(填“>”、“<”或“=”)。
②达到平衡时N2的浓度c(N2)甲__________c(N2)乙,c(N2)乙__________c(N2)丙(填“>”、“<”或“=”)。
③对甲、乙、丙三容器的描述,以下说法正确的是__________。
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率加快
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com