
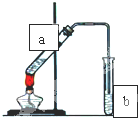
 (Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.
(Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.| 催化剂 |
| Ⅰ |
| Ⅱ |
| Ⅲ |
| 1.8g |
| 60g/mol |
 ,故答案为:
,故答案为: ;
; ,反应的类型为加聚反应;
,反应的类型为加聚反应; ,加聚反应;
,加聚反应;| Cu或Ag |
| △ |
| Cu或Ag |
| △ |
 CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O, CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;| 1.8g |
| 60g/mol |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、⑤⑥⑦ | D、①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:Ba2++NH4++Al3++SO42-+4OH-═Al(OH)3↓+NH3?H2O+BaSO4↓ |
| B、KMnO4和H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| C、在电解质溶液为氢氧化钾的甲醇燃料电池内电路中,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、FeCl2溶液中加入过量氨水 |
| D、Fe2(SO4)3溶液中加入过量KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | 实验步骤 | 实验现象 | 离子方程式 |
| SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 样品序号 | 取样深度(m) | 有机质(×10-2g) | 总铬(×10-6g) |
| 样品A-1 | 0.00~0.30 | 2.81 | 114 |
| 样品A-2 | 0.30~0.60 | 1.72 | 111 |
| 样品A-3 | 1.20~1.80 | 1.00 | 88 |
| 样品B-1 | 0.00~0.30 | 2.60 | 116 |
| 样品B-2 | 0.30~0.60 | 2.48 | 112 |
| 样品B-3 | 1.20~1.80 | 1.83 | 106 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )| A、镁铝合金的质量为0.39 g |
| B、盐酸的物质的量浓度为2mol/L |
| C、B点沉淀的质量 0.39g |
| D、镁铝与盐酸恰好完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com