
| A. |  向pH=13的NaOH溶液中不断加水稀释 | |
| B. | 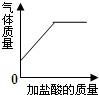 向碳酸氢钠溶液中逐滴加入稀盐酸至过量 | |
| C. | 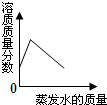 将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. | 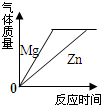 将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合 |
分析 A.氢氧化钠溶液加水稀释,溶液碱性减弱,但pH不能小于7;
B.未加盐酸时,没有气体生成;
C.60℃接近饱和的硝酸钾溶液,恒温蒸发水分至有白色晶体析出,最终形成饱和溶液,溶液质量分数先增大后保持不变;
D.等质量、相同质量分数的稀硫酸中硫酸的质量相等,由于金属足量,硫酸完全反应,生成氢气的质量相等,Mg的金属性比Zn强,Mg与硫酸反应速率更快.
解答 解:A.氢氧化钠溶液呈碱性,加水稀释,溶液碱性减弱,pH减小,但pH不能小于7,只能无限接近7,故A错误;
B.由图可知,碳酸氢钠溶液中未加盐酸时已经产生气体,而碳酸氢钠溶于水没有气体生成,故B错误;
C.60℃接近饱和的硝酸钾溶液,恒温蒸发水分至有白色晶体析出,最终形成饱和溶液,溶液质量分数先增大而后保持不变,图象与实际不符,故C错误;
D.等质量、相同质量分数的稀硫酸中硫酸的质量相等,由于金属足量,硫酸完全反应,生成氢气的质量相等,Mg的金属性比Zn强,Mg与硫酸反应速率更快,Mg与硫酸反应完全所用时间较短,故D正确;
故选:D.
点评 本题考查有关化学图象综合分析,涉及溶液pH判断、溶解度、化学方程式计算、化学反应速率影响因素等,是对学生总能力考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(B)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 反应前2min的平均速率v(B)=0.15 mol/(L•min) | |
| B. | 保持其他条件不变,升高温度,平衡时c(B)=0.22 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,起始向容器中充入2.0 mol A,反应达到平衡时C的体积分数减小 | |
| D. | 保持其他条件不变,增大该反应体系的压强,平衡左移,反应的平衡常数K减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌片逐渐溶解 | B. | 烧杯中溶液逐渐呈蓝色 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 电解质溶液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发易降解的生物农药 | |
| B. | 对燃煤进行脱硫处理 | |
| C. | 对塑料等垃圾进行深埋或倾倒入海处理 | |
| D. | 推广使用节能环保材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 钢笔使用不同牌子的墨水堵塞 | |
| C. | 一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路 | |
| D. | 向石灰水中通入二氧化碳气体产生白色浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).
.该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).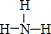 (填结构式).
(填结构式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com