
分析 A、B、C、D、E都是短周期元素,原子序数依次增大,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C为Na,B为O;A、B处于同一周期,A原子的最外层电子数比次外层电子层多3个,则A为N元素;C、D、E同处另一周期,E是地壳中含量最高的金属元素,则E为Al、D为Mg,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D、E都是短周期元素,原子序数依次增大,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C为Na,B为O;A、B处于同一周期,原子的最外层电子数比次外层电子层多3个,则A为N元素;C、D、E同处另一周期,E是地壳中含量最高的金属元素,则E为Al,所以D为Mg,
(1)D为Mg,位于元素周期表中第三周期第ⅡA族,
故答案为:第三周期第ⅡA族;
(2)A为N元素,其单质为氮气,氮气分子中含有氮氮三键,其结构式为N≡N,
故答案为:N≡N;
(3)Na、O以1:1形成离子化合物乙,则乙为Na2O2,过氧化钠中含有离子键和共价键,
故答案为:离子键、非极性键;
(4)电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径大小为:O<N<Al<Mg<Na,
故答案为:O<N<Al<Mg<Na;
(5)C的最高价氧化物对应的水化物的溶液为NaOH,与Al反应的离子反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:选择题
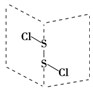 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的空间构型与H2O2相似 | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2<S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②⑤ | C. | ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | At位于第七周期第ⅦA族,其气态氢化物的稳定性比HCl的强 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SiF4和SO32-的中心原子均为sp2杂化 | |
| D. | SF6中有6对相同的成键电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸:粘合剂、耐火材料 | B. | 硅胶:干燥剂、吸附剂、催化剂载体 | ||
| C. | 碳化硅:砂纸、砂轮 | D. | 分子筛:吸附剂、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(min) | 0 | t1 | t2 | t3 |
| NH3的物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
| A. | 0~t1min内,v(NH3)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移 | |
| C. | N2(g)+3H2(g)?2NH3(g)的活化能小于2NH3(g)?N2(g)+3H2(g)的活化能 | |
| D. | t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率 | |
| B. | 单位时间内物质的浓度变化大,则化学反应速率就快 | |
| C. | 对于 2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压 条件下,均不能作为达到化学平衡状态的标志 | |
| D. | 对可逆反应 4NH3(g)+5O2(g)?4NO(g)+6H2O(g),反应达到平衡时,若两种反 应物的转化率相等,则起始投入的n(NH3):n(O2)=4:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com