
【题目】两种金属混合物共15g,投入足量的盐酸中,充分反应后得到11.2LH2(标准状况),则原混合物的组成肯定不可能为( )
A. Mg和AlB. Zn和MgC. Al和ZnD. Al和Cu
【答案】A
【解析】
标况下11.2L氢气的物质的量为0.5mol,假设金属均为+2价,金属总物质的量等于氢气物质的量,故混合金属平均摩尔质量为![]() =30g/mol,两种金属的混合物中平均摩尔质量应介于各组分之间,根据电子转移守恒,若金属不与盐酸反应,其摩尔质量可以视作无穷大。
=30g/mol,两种金属的混合物中平均摩尔质量应介于各组分之间,根据电子转移守恒,若金属不与盐酸反应,其摩尔质量可以视作无穷大。
A项、Mg的摩尔质量为24g/mol,Al与盐酸反应表现+3价,假设Al为+2价时,摩尔质量为![]() ×27g/mol= 18g/mol,两种金属的摩尔质量均小于30g/mol,不符合题意,故A错误;
×27g/mol= 18g/mol,两种金属的摩尔质量均小于30g/mol,不符合题意,故A错误;
B项、Mg的摩尔质量为24g/mol,Zn的摩尔质量为65g/mol,二者的平均摩尔质量可以是30g/mol,符合题意,故B正确;
C项、Al与盐酸反应表现+3价,假设Al为+2价时,摩尔质量为![]() ×27g/mol= 18g/mol,n的摩尔质量为65g/mol,二者的平均摩尔质量可以是30g/mol,符合题意,故C正确;
×27g/mol= 18g/mol,n的摩尔质量为65g/mol,二者的平均摩尔质量可以是30g/mol,符合题意,故C正确;
D项、Al与盐酸反应表现+3价,假设Al为+2价时,摩尔质量为![]() ×27g/mol= 18g/mol,不Cu与盐酸反应,其摩尔质量可以视作无穷大,二者的平均摩尔质量可以是30g/mol,符合题意,故D正确。
×27g/mol= 18g/mol,不Cu与盐酸反应,其摩尔质量可以视作无穷大,二者的平均摩尔质量可以是30g/mol,符合题意,故D正确。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.钢铁吸氧腐蚀中的正极反应:4OH 4e-=2H2O +O2↑
B.工业上用电解法制铝:2AlCl3(熔融)![]() Al+3Cl2↑
Al+3Cl2↑
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:![]() + 6H+ + 5H2O2=2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2=2Mn2+ + 5O2↑ + 8H2O
D.AgNO3 溶液中加入少量氨水;Ag+ + NH3·H2O = AgOH↓+ NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.8g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为()
A.8.71gB.8.455g
C.8.51gD.7.04g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种重要的有机化工合成中间体F和Y可用甲苯为主要原料采用以下路线制得:
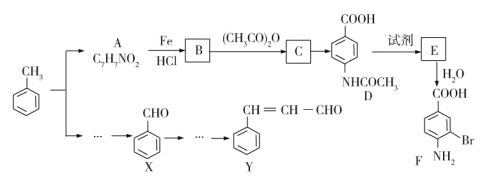
已知:
①![]()
![]()
![]()
②2CH3CHO![]() CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO![]() CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
(1)写出A的结构简式___________。
(2)B→C的化学方程式是________。
(3)C→D的反应类型为__________。
(4)1molF最多可以和________molNaOH反应。
(5)在合成F的过程中,设计B→C步骤的目的是_________。
(6)写出符合下列条件的3种A的同分异构体的结构简式_________、______、_______。
①苯环上只有两种不同化学环境的氢原子
②能发生银镜反应
(7)以X和乙醇为原料通过3步可合成Y,请设计合成路线______(无机试剂及溶剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理,实验时关闭图1中的a,用单孔塞(插有吸入水的胶头滴管)塞紧颈口c,将水挤入三颈烧瓶中,打开b,完成喷泉实验。电脑绘制三颈烧瓶内压强变化曲线图2。下列说法正确的是
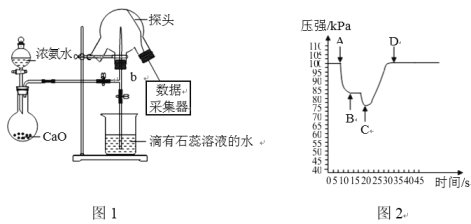
A.干燥氨气通常可选用浓硫酸B.三颈烧瓶内可以看到红色喷泉
C.由图2可知C点时喷泉最剧烈D.图1中氧化钙可用氯化钙代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
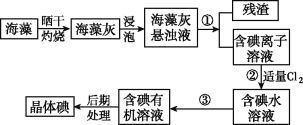
(1)实验室灼烧海藻,需要下列仪器中的____(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:
①________③_______。
(3)提取碘的过程中,可选择的有机试剂是_____。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有____、____。
(5)小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈___色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_____。
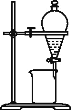
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
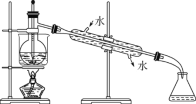
①______;
②______;
③______。
(7)进行上述蒸馏操作时,使用水浴加热的原因是___,最后晶态碘在____里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1) Se元素基态原子的电子排布式为____;第四周期中第一电离能比Se元素大的共有____种(氪元素除外)。
(2)气态SeO3分子的价层电子对互斥模型为____ ;SeO42-离子中Se原子的杂化方式为 ___ 。
(3)固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如下图1所示)。
①图1中Se-O键键长较短的是 ___(填“a"或“b"),其原因是______。
②SeO2熔点为350℃,固态SeO2属于___晶体,其熔点远高于SO2(-75.5℃)的原因是 ____。
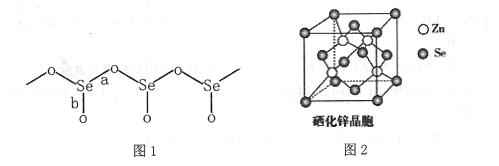
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= ____nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为________ g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯(图 a)是一种由单层碳原子构成的平面结构新型导电材料,具有大п共轭体系。石墨烯 中部分碳原子被氧化后,其平面结构发生改变,转化为氧化石墨烯(图b)。
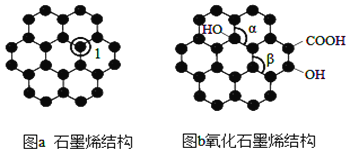
(1)图a中,1号C的杂化方式为______,石墨烯中含有的化学键类型是_____(填极性键,非极性键);图b中键角α____键角β(填“ >”、“<”或“=”),水分子的空间构型是____。
(2)基态钒原子的价电子排布式为______。
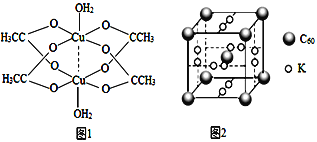
(3)醋酸铜可合成复合材料石墨烯![]() ,其制备原料为CuSO4、NH3·H2O和醋酸等。
,其制备原料为CuSO4、NH3·H2O和醋酸等。
①写出一种与SO42-互为等电子体的分子______。
②二聚醋酸铜的结构示意图如图1所示,Cu2+的配位数为______。
(4)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图2所示,晶胞边长参数为anm,该化合物中K原子和C60分子的个数比为_____,该晶体的密度ρ=_____ g.cm-3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com