
下列说法不正确的是(设NA为阿伏加德罗常数的数值)( )
A. 20g重水含有10NA个电子
B. 1L 0.1 mol•L﹣1 Na2SO3溶液中含有的SO32﹣数目少于0.1NA个
C. 使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
D. 用足量铜粉除去FeCl2溶液中的FeCl3杂质
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A.根据n=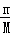 计算20g重水的物质的量,每个重水分子含有10个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;
计算20g重水的物质的量,每个重水分子含有10个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;
B.SO32﹣在溶液中发生水解,浓度小于0.1mol/L,根据n=cV、N=nNA进行判断;
C.俯视刻度线,液面在刻度线下方,所配溶液的体积偏小,结合c=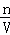 判断;
判断;
D.引入新的杂质铜离子.
解答: 解:A.20g重水的物质的量为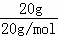 =1mol,每个重水分子含有10个电子,含有电子物质的量为10mol,故含有电子数目为10mol×NAmol﹣1=10NA,故A正确;
=1mol,每个重水分子含有10个电子,含有电子物质的量为10mol,故含有电子数目为10mol×NAmol﹣1=10NA,故A正确;
B.SO32﹣在溶液中发生水解,浓度小于0.1mol/L,SO32﹣的物质的量小于0.1mol/L×1L=0.1mol,故SO32﹣数目小于0.1mol×NAmol﹣1=0.1NA,故B正确;
C.俯视刻度线,液面在刻度线下方,所配溶液的体积偏小,由c=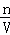 可知所配溶液的浓度偏高,故C正确;
可知所配溶液的浓度偏高,故C正确;
D.铜与氯化铁反应生成氯化亚铁与氯化铁,引入新的杂质铜离子,故D错误;
故选D.
点评: 本题考查常用化学计量的有关计算、溶液配制误差分析、物质提纯等,B选项注意考虑盐类水解,D选项注意除杂原则.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42﹣;
4H++2Fe2++4SO42﹣;
②4Fe2++O2+4H+ 4Fe3++2H2O;
4Fe3++2H2O;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2
4H++2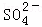 .
.
已知:FeS2中的铁元素为+2价.
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整.
(2)反应③的还原剂是 .
(3)观察上述反应,FeS2最终转化为 从煤炭中分离出来.
查看答案和解析>>
科目:高中化学 来源: 题型:
图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是()
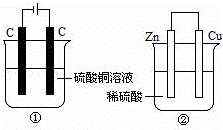
A. 产生气体体积:①=②
B. ①中阴极质量增加,②中正极质量减小
C. 电极反应式:①中阳极:4OH﹣﹣4e﹣=2H2O+O2↑②中负极:2H++2e﹣=H2↑
D. 溶液的pH变化:①减小,②增大
查看答案和解析>>
科目:高中化学 来源: 题型:
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人.那么,这种做法的化学原理是( )
A. 胶体的电泳 B. 血液的氧化还原反应
C. 血液中发生复分解反应 D. 胶体的聚沉
查看答案和解析>>
科目:高中化学 来源: 题型:
现有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,Y、Z、W、Q形成的简单离子具有相同的电子层结构,YX3、X2Z、X2Z2、W2Z、W2Z2都是常见的化合物,其中,YX3在常温下呈气态,能使酚酞溶液变红色.下列有关推断正确的是( )
A. 简单离子半径:Y>Z>W>Q>X
B. W2Z2与X2Z反应中氧化剂与还原剂物质的量之比为1:2
C. X能分别与Y、Z、W形成共价化合物
D. Y、W、Q的最高价氧化物对应的水化物两两之间一定相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子:aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径 A>B>D>C B. 原子序数 d>c>b>a
C. 离子半径 C>D>B>A D. 单质的还原性 A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
0.3mol气态高能燃料乙硼烷B2H6在O2中燃烧,生成固态B2O3和液态H2O,放出649.5kJ的热量.下列热化学方程式正确的是()
A. B2H6(g)+302(g)═B2O3(s)+3H2O(l)△H=2165 kJ•mol﹣1
B. B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=﹣2165 kJ•mol﹣1
C. B2H6+3O2═B2O3+3H2O△H=﹣2165 kJ•mol﹣1
D. B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=﹣2165 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 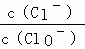 的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是()
的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是()
A. 若某温度下,反应后 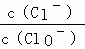 =11,则溶液中
=11,则溶液中 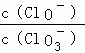 =
=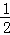
B. 参加反应的被还原的氯气为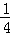 amol
amol
C. 改变温度,反应中转移电子的物质的量ne的范围: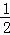 amol≤ne≤
amol≤ne≤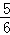 amol
amol
D. 改变温度,产物中KClO3的最大理论产量为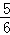 amol
amol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com