
X、Y、Z、W均为短周期元素,原子序数依次增大。Y原子的M电子层有1个电子,同周期的简单离子的半径中Z最小。W与X同主族,其最高化合价是最低负化合价绝对值的3倍。下列说法正确的是( )
A. 原子半径的大小:W > Z> Y
B. 简单气态氢化物的热稳定性: W > X
C. Y、Z、W最高价氧化物对应水化物能够两两发生反应
D. 简单离子的还原性:X> W
科目:高中化学 来源:2016-2017学年山东省高二上期中化学卷(解析版) 题型:填空题
根据题目要求回答下列各小题:
(1)泡沫灭火器中装有硫酸铝和碳酸氢钠溶液,二者混合时发生剧烈反应,请写出灭火时发生 反应的离子方程式:
反应的离子方程式: 
(2)请写出明矾[K Al(SO4)2 .12 H2O]做净水剂净水时的离子方程式
(3)利用纯碱溶液的碱性可以去除油污,呈碱性的原因是(填离子方程式):
(4)物质的量浓度相同的 ①氯化铵;② 碳酸氢铵;③ 硫酸氢铵; ④硫酸铵4种溶液中,c(NH4+)由大到小的顺序是_____ (填写序号)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上月考二化学卷(解析版) 题型:选择题
下列说法正确的是
A.液态氯化氢、固体氯化钠均不导电,所以氯化氢、氯化钠均是非电解质
B.铜丝能导电,所以铜丝是电解质
C.NH3、SO2的水溶液均能导电,所以NH3、SO2均是电解质
D.蔗糖、酒精在水溶液和熔化状态下均不导电,所以它们是非电解质
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上学期12月月考化学试卷(解析版) 题型:实验题
某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取粗铜和绿矾(FeSO4·7H2O)产品,设计流程如下:
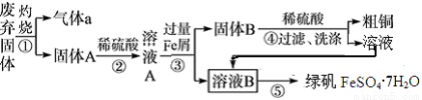
(1)气体a为________
(2)固体B的主要成分为____________
(3)溶液B在空气中放置有可能变质,如何检验溶液B是否变质:_________________________
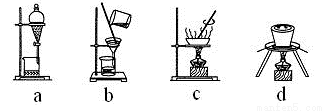
(4)下列实验操作中,步骤⑤中需要用到的是________(填字母)。
(5)为测定产品中绿矾的质量分数,称取40.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.80 | 20.02 | 19.98 | 20.00 |
① 请写出有关滴定的离子方程式_____________________
② 第1组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定前尖嘴有气泡,滴定后气泡消失
d.滴定终点时俯视读数
③ 根据表中数据,计算所得产品中绿矾的质量分数为_________(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上学期12月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.氧化钠、冰醋酸、硫酸钡都是电解质
B.电解、电离、电化学腐蚀均需在通电条件下才能发生
C.高氯酸、纯碱、氯化钾分别属于酸、碱、盐
D.福尔马林、漂白粉、胆矾均为混合物
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:填空题
Ⅰ 能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(l)十3O2(g) 2CO2(g)+4H2O(g) △H=—1275.6 kJ·mol—1
②H2O(l) H2O(g) △H=+44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为 。
Ⅱ 甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=―890.3kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH2=―566.0kJ/mol
(3)则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
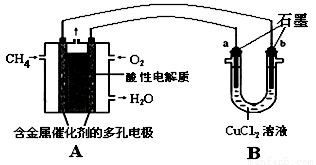
请回答:当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:实验题
某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。该同学取一定量Na2O2样品与过量 水反应,待完全反应后,得到溶液X和一定量O2 。
水反应,待完全反应后,得到溶液X和一定量O2 。
(1)写出Na2O2与水反应的化学方程式 。
理论上每消耗7.8g Na2O2转移的电子数为 ,生成的氧气在标况下的体积是 。
(2)该同学推测反应中可能生成了H2O2,并进行实验探究。试设计实验帮助该同学证明溶液X中含过氧化氢 。
(3)通过上述实验证明溶液中确实存在H2O2 ,取少量X于试管中,滴加FeCl 2溶液,立即生成红褐色沉淀,写出反应的离子方程式: ,该反应中H2O2表现了 性(填“氧化”或“还原”)。
2溶液,立即生成红褐色沉淀,写出反应的离子方程式: ,该反应中H2O2表现了 性(填“氧化”或“还原”)。
(4)该同学发现溶液X还可使酸性KMnO4溶液褪色,同时放出氧气,判断该反应中H2O2表现了 性(“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
将铁粉、铜粉、 FeCl3 溶液和 CuCl2 溶液混合在试管中充分反应,若过滤后滤渣能被磁铁吸引,则下列有关叙述正确的是( )
A.溶液中肯定不存在的离子只有 Cu2+ B. Fe3+和 Cu2+均能被铁粉还原
C.滤液中滴加 KSCN 溶液显红色 D.滤渣中肯定不含有铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com