
| A. | 常温常压下,0.1mol二氧化硅中所含硅氧键数目为0.2NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 常温常压下,46gNO2含有原子数为3 NA(相对原子质量N:14 O:16) | |
| D. | 标准状况下,11.2LSO3含有分子数为0.5NA |
分析 A、1mol二氧化硅含4molSi-O键;
B.稀盐酸与二氧化锰不反应,当浓盐酸浓度减小到一定程度反应停止,盐酸有剩余;
C.46gNO2中含有的NO2的物质的量为1mol,则含3NA个原子;
D.标准状况下三氧化硫不是气体.
解答 解:A、Si能形成4个共价键,所以0.1mol二氧化硅含0.4molSi-O键,故A错误;
B.稀盐酸与二氧化锰不反应,当浓盐酸浓度减小到一定程度反应停止,盐酸有剩余,所以含0.6molHCl的浓盐酸与足量二氧化锰加热时,HCl有剩余,转移的电子数小于0.3NA,故B错误;
C.常温常压下,46gNO2 物质的量=$\frac{46g}{46g/mol}$=1mol,含有原子数为3 NA,故C正确;
D.标准状况下,11.2LSO3含物质的量不是0.5mol,分子数不是0.5NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的应用,二氧化硅中硅的成键特点,氧化还原反应电子转移的计算等,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A.检验某溶液中是否含有K+ | B.除去CO中的CO2 | C.实验室制取氯气 | D.加热分解NaHCO3固体 |
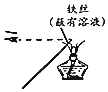 |  | 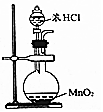 | 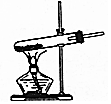 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
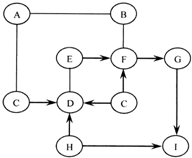 图中A~I是初中化学常见的物质,且分别是由H、C、O、Na、Al、S、Ca、Cu、Ag中的一种或几种元素组成的.
图中A~I是初中化学常见的物质,且分别是由H、C、O、Na、Al、S、Ca、Cu、Ag中的一种或几种元素组成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应等加热至蒸发皿中剩余较少液体时,立即停止加热 | |
| B. | 蒸馏操作时,应使温度计液泡靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21世纪,化学还将继续推动材料科学的发展,使各种新型功能材料的生产成为可能 | |
| B. | 化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器 | |
| C. | 放射性元素的发现和现代量子化学理论的建立,都是进入20世纪后现代化学的重大成就 | |
| D. | 法国科学家拉瓦锡提出原子学说,为近代化学的发展奠定了坚实的基础 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
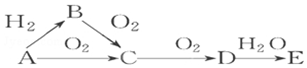 已知A是气体单质,E的水溶液显强酸性.A、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生如图所示的转化.
已知A是气体单质,E的水溶液显强酸性.A、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生如图所示的转化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol/L甲酸溶液中的c(H+)约为1×10-2mol•L-1 | |
| B. | 甲酸能与碳酸钠反应放出二氧化碳 | |
| C. | 10 mL 1 mol•L-1甲酸溶液恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 甲酸溶液与锌反应比强酸溶液与锌反应缓慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com