
| A.稀硫酸 | B.稀硝酸 | C.KSCN溶液 | D.酸性高锰酸钾溶液 |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
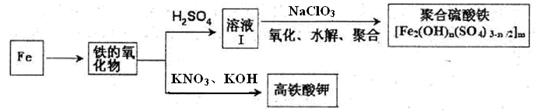
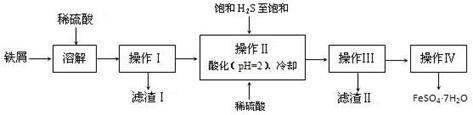
科目:高中化学 来源:不详 题型:填空题
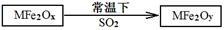
查看答案和解析>>
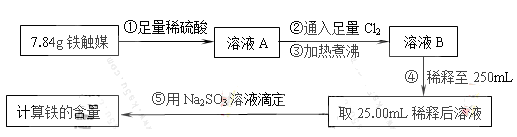
科目:高中化学 来源:不详 题型:实验题
| A.酚酞 | B.石蕊 | C.甲基橙 | D.不需要 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 过程 | 思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ | ①根据氧化还原反应原理,一般 物质有还原性, 物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 | ②用离子方程式表示选择H2O2的原因 ③用离子方程式表示溶液变血红色的原因 |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 | ④选择铁粉的原因是 (用化学方程式表示) ⑤为什么要用煮沸的水 |
| 4.实施实验 | …… |
| …… | …… |
查看答案和解析>>
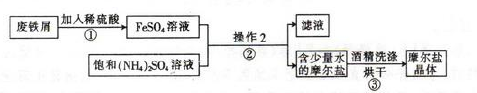
科目:高中化学 来源:不详 题型:实验题
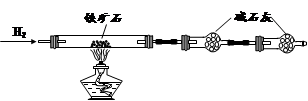
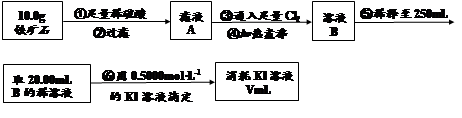
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验操作 | 现象 | 目的或结论 |
| 步骤1:取适量上述热分解后的固体于试管中,加入0.1 mol/L H2SO4溶液使其充分溶解,将上层清液分加到A、B两支试管中 | | 溶解固体产物 |
| 步骤2: | | 溶液中含有Fe3+ |
| 步骤3: | | 溶液中不含 Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
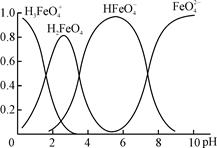
查看答案和解析>>
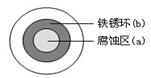
科目:高中化学 来源:不详 题型:单选题
| A.最后得到的溶液中含有Fe3+ | B.残余固体可能为铁、铜混合物 |
| C.最后得到的溶液中只含Cu2+ | D.残余固体一定全部是铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com