
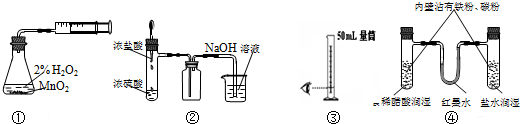
| A. | 装置①制取并收集纯净的氧气 | B. | 装置②制取并吸收HCl | ||
| C. | 装置③量取8.5mL的稀硫酸 | D. | 装置④模拟铁的腐蚀 |
分析 A.过氧化氢分解生成氧气,但装置中空气无法排出;
B.浓盐酸易挥发,浓盐酸与浓硫酸混合时放出热,HCl的密度比空气密度大,且与NaOH溶液反应,但导管在液面下可发生倒吸;
C.液体的体积应与量筒的规格接近,减小误差;
D.左侧电解质为酸,发生析氢腐蚀,右侧盐水为中性,发生吸氧腐蚀.
解答 解:A.过氧化氢分解生成氧气,但装置中空气无法排出,不能得到纯净的氧气,故A错误;
B.浓盐酸易挥发,浓盐酸与浓硫酸混合时放出热,HCl的密度比空气密度大,且与NaOH溶液反应,但导管在液面下可发生倒吸,则图中吸收尾气时选倒扣的漏斗防止倒吸,故B错误;
C.液体的体积应与量筒的规格接近,减小误差,应选10mL量筒量取8.5mL的稀硫酸,故C错误;
D.左侧电解质为酸,发生析氢腐蚀,右侧盐水为中性,发生吸氧腐蚀,则利于红墨水的移动可观察,装置④可模拟铁的腐蚀,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用、实验技能为解答本题的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和的石灰水中加入少量固体烧碱 | |
| B. | 饱和碳酸钠溶液中通入足量二氧化碳 | |
| C. | 氯化钙溶液中通入足量二氧化碳 | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 操作 | 现象 |
| A | 滴有酚酞的明矾溶液 | 加热 | 颜色变深 |
| B | 滴有酚酞的氨水 | 加入少量NH4Cl固体 | 颜色变浅 |
| C | 滴有酚酞的CH3COONa溶液 | 加入少量NH4NO3固体 | 颜色变浅 |
| D | 氯化铁溶液 | 加热 | 颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL | B. | 250mL | C. | 100mL | D. | 1000mL | ||||
| E. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
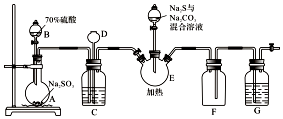 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:| 实验方案 | 现象 | 结论 |
| ①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
| ②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 | 仍有白色沉淀 | 产品中含Na2SO4 |
| 品红试纸不褪色 | 产品中不含Na2SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com