
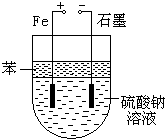
 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.分析 (1)为防止Fe(OH)2被氧化,根据气体的溶解性与温度的关系解答;
(2)为防止Fe(OH)2被氧化,应隔绝空气;
(3)此装置属于电解池,与正极相连的铁作阳极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,与负极相连的石墨作阴极,发生还原反应,电极方程式为2H++2e-=H2↑,而阳极如果换成其他材料,就不能产生Fe2+;
(4)反接电源时,电解方程式是2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,生成的O2会将Fe(OH)2氧化.
解答 解:(1)为防止Fe(OH)2被氧化,根据气体的溶解性随着温度的升高而减小,则煮沸相当于升高温度应除去溶液中溶解的氧气,故答案:除去溶液中溶解的O2;
(2)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,故答案为:隔绝空气防止氢氧化亚铁被氧化;
(3)此装置属于电解池,与正极相连的铁作阳极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,与负极相连的石墨作阴极,发生还原反应,电极方程式为2H++2e-=H2↑;而阳极如果换成其他材料,就不能产生Fe2+,从而就不可能制取到Fe(OH)2,故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;不能;
(4)反接电源时,电解方程式变为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阳极电极方程式为4OH--4e-=O2↑+2H2O,阴极电极方程式为4H++4e-=2H2;生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:4OH--4e-=O2↑+2H2O;4H++4e-=2H2↑;白色沉淀迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查氢氧化亚铁的制备和电解原理,明确电解原理及Fe为阳极是解答本题的关键,注意实验中防止氢氧化亚铁被氧化,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
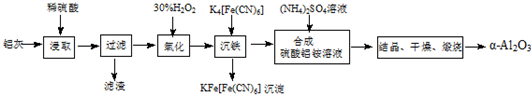
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )
某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )| A. | 2min内,X的平均反应速率为0.25mol/(L•min) | |
| B. | 第5min时,该反应达到平衡状态 | |
| C. | 第5min后,Y的生成速率与X的消耗速率相等且保持不变 | |
| D. | 5min内,反应放出的热量为1.6QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷与氢氧化钠溶液共煮后,加入硝酸银检验Br- | |
| B. | 用电石和饱和食盐水制取乙炔 | |
| C. | 用苯、12mol/L的硝酸和18mol/L的硫酸制硝基苯 | |
| D. | 用稀硝酸洗涤做过银镜反应的试管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com