
【题目】合金是一类用途广泛的金属材料.下列物质中,不属于合金的是( )
A. 水银 B. 青铜 C. 碳素钢 D. 不锈钢
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是

A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
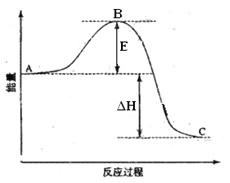
(1)图中A、C分别表示 、 ,
E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1
,则υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,求由S(s)生成3 molSO3(g)的△H= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知石墨和金刚石燃烧化学方程式如下:
C(石墨,s)+O2(g)==CO2(g)
C(金刚石,s)+O2(g)==CO2(g)
质量分别为12 g的石墨和金刚石在某一相同条件下燃烧时放出的热量分别为393.8 kJ和395.2 kJ,问:对于单质来说,稳定的单质是石墨还是金刚石?简述理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
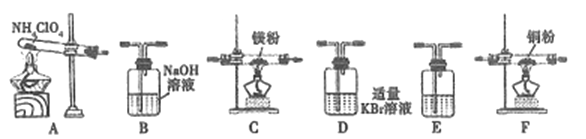
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:

步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳热还原制备氮化铝的总反应化学方程式为:Al2O3(s)+3C(s)+N2(g)![]() 2AlN(s)+3CO(g)。在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示。下列说法不正确的是
2AlN(s)+3CO(g)。在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示。下列说法不正确的是

A. 在不同时刻都存在关系:v(N2)=3v(CO)
B. c点切线的斜率表示该化学反应在t时刻的瞬时速率
C. 从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
D. 维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为3L的密闭容器内进行如下反应:A2(气)+3B2(气)===aX(气)。反应开始时,n(A2)=1.5mol,n(B2)= 4.0mol,2min后,n(B2)=0.4mol, n(X)=2.4mol。计算:
(1)a值______________
(2)X的表示式(用A、B表示)________________
(3)υ(B2)为_____________
(4)2min末的A2的浓度_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量的乙烯时,常利用乙醇和浓硫酸快速加热到170℃来制取。此实验常因温度过高而发生副反应。有部分乙醇跟浓H2SO4反应生成SO2、C02、水蒸气和炭黑。
I.用方程式表示乙烯制备的反应原理____;乙烯制备时,在140℃常伴随有副反应发生,化学方程式为_____。
Ⅱ.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试完成下列问题:
(1)图中①②③④装置可盛放的试剂是(试剂可重复使用,也可不使用):(填写ABCD)
①_____;②____;③_____;④______。
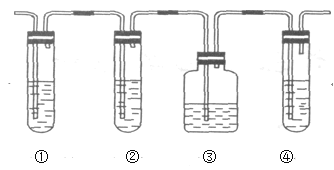
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是______。
(3)使用装置②的目的是___________。
(4)使用装置③的目的是______________。
(5)确证含有乙烯的现象是_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com