
| A. | 一定含有NaHCO3 | B. | 一定含有K2CO3 | C. | 可能含有NaHCO3 | D. | 一定含有NaCl |
分析 n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,则$\overline{M}$=$\frac{10.6g}{0.1mol}$=M(Na2CO3)=106g/mol,又M(K2CO3)>M(Na2CO3)>M(NaHCO3),因NaCl与盐酸不反应,且K2CO3的相对分子质量大于碳酸钠,则一定含有NaHCO3,以此解答该题.
解答 解:n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,则$\overline{M}$=$\frac{10.6g}{0.1mol}$=M(Na2CO3)=106g/mol,又M(K2CO3)>M(Na2CO3)>M(NaHCO3),
因NaCl与盐酸不反应,则实际与盐酸反应的碳酸钠质量小于10.6g,如$\overline{M}$仍等于106g/mol,则杂质的相对分子质量小于碳酸钠,则一定含有NaHCO3,K2CO3、NaCl至少含有一种,
故选A.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,注意把握物质的相对分子质量的关系,梳理做题思路,难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
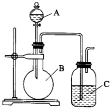 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分解温度:CH4>H2S | B. | 氧化性:NaClO>Na2SO3 | ||
| C. | 同浓度溶液pH:Na2SiO3>Na2CO3 | D. | 金属性:Ca>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
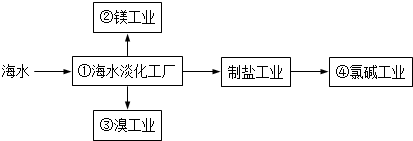
| A. | ①中可采用蒸馏法 | B. | ②中可通过电解法制金属镁 | ||
| C. | ③中提溴涉及到复分解反应 | D. | ④的产品可生产盐酸、漂白液等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA | |
| B. | 标准状况下,22.4 mL Br2所含的分子数为0.001NA | |
| C. | 标准状况下,22.4L的Cl2与1mol Fe充分反应,转移的电子数为3NA | |
| D. | 100 mL 0.1 mol•L-1的H2SO3溶液中,电离出的H+总数为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 除去乙烷中少量乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
| B | 检验乙醇和乙酸溶液 | 分别在乙醇和乙酸中加入氢氧化钠溶液 |
| C | 制备少量氯化氢气体 | 向浓硫酸中滴加浓盐酸 |
| D | 证明Fe 3+的氧化性比Cu2+强 | 在氯化铜溶液中加入铁粉、振荡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com