
下列有关说法正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度增大
D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
为了探索外界条件对反应aX(g)+bY(g) cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。
cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。

下列判断正确的是
A.ΔH>0 a+b>c B.ΔH<0 a+b<c
C.ΔH<0 a+b>c D.ΔH>0 a+b<c
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:填空题
(15分)开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。

回答下列问题:
(1)反应②的化学方程式为 。
(2)反应④的离子方程式为 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 (填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为 。
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00 m3 天然气理论上可制得氢气 m3(同温同压条件下)。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物)。
①生成目标产物的电极反应式为 。
②该储氢装置的电流效率为η= 。(η=  ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)

查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),反应达到平衡时,X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1.则下列判断不正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),反应达到平衡时,X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1.则下列判断不正确的是
A.c1∶c2== 1∶3 B.平衡时,Y和Z生成速率之比为3∶2
C.X、Y的转化率不相等 D.c1的取值范围为0< c1< 0.14 mol?L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
某反应过程能量变化如图所示,下列说法正确的是
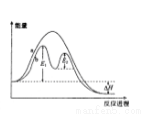
A.反应过程a有催化剂参与
B.该反应为吸热反应,热效应等于ΔH
C.改变催化剂,可改变该反应的活化能
D.有催化剂条件下,反应的活化能等于E1+E2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
下列实验操作中,错误的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.配制90mL1mol/L的NaOH溶液选用100 mL容量瓶
C.用pH试纸测得新制氯水的pH为2
D.用酸式滴定管准确量取10.00mLKMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等五校高三联考理综化学试卷(解析版) 题型:填空题
(16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:

已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42- (aq) △H>0
PbCl42- (aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、7.04
(1)步骤Ⅰ中FeCl3溶液与PbS反应生成PbCl2和S的离子方程式为 ,步骤Ⅰ中另一个反应是H2O2与FeCl2、盐酸反应生成FeCl3,实现FeCl3的重复利用,其离子方程式为 ,加入盐酸的另一个目的是为了控制pH在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)滤液3是 。
(5)铅蓄电池的电解液是稀硫酸(22%~28%),充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,铅蓄电池充电时阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高一上学期期中考试化学试卷(解析版) 题型:选择题
氰化物有剧毒,我国工业废水中氰化物 的最高允许排放浓度为0.5 mg/L;对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水的中CN-转化成N2和CO2等,使废水得到净化。发生的反应为:
的最高允许排放浓度为0.5 mg/L;对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水的中CN-转化成N2和CO2等,使废水得到净化。发生的反应为:
下列有关说法正确的是
A.上述反应中氧化剂是CN-
B.现取1 L含CN-1.02 mg/L的废水,至少需用4.0×10-5mol Cl2处理后才符合排放标准
C.若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2 mol
D.当有0.4 mol CO2生成时,反应中转移的电子的总数目约为2×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(文)试卷(解析版) 题型:?????
容量瓶常见的规格有
A.50mL B.100mL C.180mL D.1000mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com