
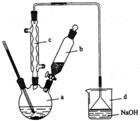
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
分析 本题是根据苯的性质,利用苯和液溴通过取代反应制备溴苯的实验设计题,涉及反应原理的探究、溴化氢的尾气处理措施,反应后混合物的分离与提纯,反应中生成了溴化氢,因其极易溶解于水,实验中可观察到有白雾,反应后的混合物因水溶液与有机物不相溶,可选择分液分离,但因溴易溶于有机溶剂,故需要用氢氧化钠溶液洗涤,使之转化为可溶于的盐,最后得到的溴苯中混有的苯,可以根据沸点差异选择蒸馏分离;
(1)苯与液溴反应生成HBr,HBr遇水蒸气形成白雾;苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气;
(2)苯与液溴在催化剂的作用下发生反应的同时还能放热,而反应物苯和液溴都易挥发,为减少反应物挥发并提高原料的利用率可以通过温度的控制来实现,只要温度低于二者的沸点就可以了;
(3)①根据溴苯中含有溴,单质溴能与NaOH溶液反应生成NaBr和NaBrO溶于水中,而溴苯不与NaOH溶液反应,也微溶于水,可以通过分液进行分离;
②经过水洗分液分离后得到的粗溴苯,因溴苯微溶于水,故粗溴苯中仍有少量水份,加入的氯化钙有吸水性,可综合考虑氯化钙的作用;
(4)根据因苯与溴苯混溶,分离出的粗溴苯中应含有未反应的苯,分离互溶的液体,利用沸点不同,可采用蒸馏的方法进行分离.
解答 解:(1)苯与液溴反应生成HBr,HBr遇水蒸气形成白雾;苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,故答案为:HBr;吸收HBr和Br2;
(2)根据表中苯和液溴的沸点,选择控制温度,确保温度在二种反应物的沸点之下,则应选择温度为低于59℃,故答案为:C;
(3)溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中,然后加干燥剂,无水氯化钙能干燥溴苯,故答案为:除去HBr和未反应的Br2;干燥;
(4)反应后得到的溴苯中溶有少量未反应的苯,苯和溴苯互溶,但苯的沸点低,所以采用蒸馏的方法进行分离,溴苯留在母液中,故答案为:苯;C.
点评 本题主要考查了溴苯的制取实验、物质的分离提纯等,清楚制备的原理是解答的关键,题目难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
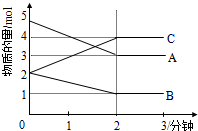 (1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
(1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

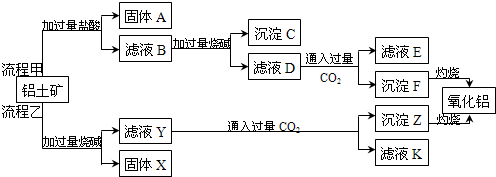
| 编号 | 装置缺陷和不妥之处 |
| ① | |
② | |
③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
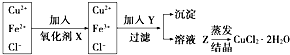 工业上制取纯净的CuCl2•2H2O的主要过程是:
工业上制取纯净的CuCl2•2H2O的主要过程是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
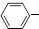 C2H5(g)?
C2H5(g)?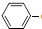 CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:
CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| C. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中:Cl-、HCO3-、K+、Ba2+ | |
| B. | FeCl3溶液中:K+、NH4+、Br-、SCN- | |
| C. | $\frac{c{(H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | KMnO4的溶液中:H+、SO42-、CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com