
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 |
分析 酸性高锰酸根离子具有强氧化性,能够将草酸氧化成二氧化碳气体,据此写出反应的离子方程式;
(1)探究反应物浓度、温度、催化剂对反应速率影响,需在其它条件相同的条件下设置对比实验;
(2)对比实验I和IV,根据两个实验中反应物不同量分析实验目的;对比实验中,必须确保溶液总体积相同.
解答 解:草酸与高锰酸钾在酸性条件下反生氧化还原反应,反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(1)由实验目的可知,探究反应物浓度、温度、催化剂对反应速率影响,需在相同的条件下对比实验,同浓度溶液,在相同温度下进行反应,Ⅰ无催化剂,Ⅱ有催化剂,Ⅰ、Ⅱ是研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,则除了温度不同外,其它条件必须完全相同,所以Ⅰ和Ⅲ是探究温度对反应速率的影响,
故答案为:Ⅰ;Ⅱ;Ⅰ;Ⅲ;
(2)对比实验I和IV,10%硫酸的体积不同,说明两组实验中的反应物的浓度不同,所以探究的是反应物的浓度对化学反应速率的影响;
对比实验I和IV,Ⅳ中只加入1mL10%硫酸,与I中加入的溶液总体积不相等,实验IV中需要加入1mL蒸馏水,确保反应溶液的总体积相同,
故答案为:硫酸的浓度或氢离子浓度;1;确保溶液总体积不变.
点评 本题主要结合实验考查了探究外界条件对化学反应速率的影响,题目难度中等,注意把握实验原理,明确温度、催化剂、浓度等因素对化学反应速率的影响.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2和H2的体积比为4:1 | ||
| C. | 反应中共消耗Zn 97.5g | D. | 反应中共转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
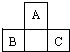 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则 ,A的氢化物分子式为H2O;
,A的氢化物分子式为H2O;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5mol C3H8分子中含C-H共价键2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
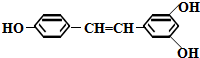 ,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )| A. | 13种 | B. | 15种 | C. | 17种 | D. | 19种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
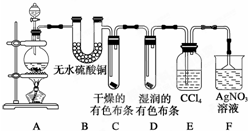 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 实验操作 | 主要现象 | 结论或解释 |
| 步骤1:取少量固体于试管中,加入足量 ①氯化铁溶液. | 固体减少且剩余, 淡黄色溶液变浅. | 固体中含有金属铁 |
| 步骤2:分离步骤1的剩余固体于另一试管中,加入足量 ②盐酸,将反应后溶液分成甲、乙两份. | 固体全部消失. | 反应的化学方程式 ③ Fe3O4+8HCl=FeCl2+2FeCl3+H2O. |
| 步骤3:在步骤2的甲溶液中加入几滴 ④高锰酸钾溶液. | 紫红色褪去. | 溶液中含有Fe2+. |
| 步骤4:在步骤2的乙溶液中加入几滴⑤KSCN溶液. | 溶液变成红色. | 溶液中含有Fe3+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 9.5 | C. | 1 0.5 | D. | 1 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm互为同位素 | |
| B. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com