
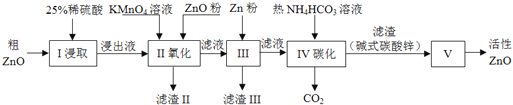
����Ŀ����������п��һ�ֶ���Ե����������ϣ�ijС���Դ�����п��������ͭ�������Ϊԭ��ģ�ҵ������������п���������£�
��֪����������������pH��Χ���±���ʾ��
Zn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ����pH | 5.4 | 7.0 | 2.3 | 4.7 |
��ȫ����pH | 8.0 | 9.0 | 4.1 | 6.7 |
����������
��1������I������25%ϡ�������98%Ũ���ᣨ�ܶ�Ϊ1.84g/mL�����ƣ���������������������ձ��⣬����Ҫ_______��ѡ���ţ�
A��������ƽ B����Ͳ C������ƿ D����ͷ�ι�
��2������II��ͨ������KMnO4����������ZnO����pH�����Գ�ȥ�������ʣ���������Ƿ���ȫ��ʵ�������_________������pH�����˷�Χ��_________��
��3������III�м���Zn�۵������ǣ���________���ڽ�һ��������ҺpH��
��4������IV��ʹ����NH4HCO3��Һ�ܴٽ�Zn2+ת��Ϊ���������¶Ȳ��˹��ߣ���ԭ�������________��
��5������V��_______�����������ƣ��н��У���֪��ʽ̼��п�Ļ�ѧʽΪZn5��OH��6��CO3��2����д��������Ӧ�Ļ�ѧ����ʽ��________���ж��ѷֽ���ȫ�IJ�����________��
��6�������·����ⶨ���û�������п�Ĵ��ȣ�
��ȡ1.000g��������п����15.00mL 1.000mol/L������Һ��ȫ�ܽ�
����Ũ��Ϊ0.500mol/L�ı�����������Һ�ζ�ʣ�����ᣬ�����յ�ʱ��������������Һ12.00mL��
�������ʲ����뷴Ӧ�������û�������п�Ĵ���Ϊ_______�����ڵζ�ʱ��ʵ�ʲ����й�����Σ�1mL��ҺΪ25�Σ����εζ���������Ϊ_____��
���𰸡�bd ȡ������Һ���μ�KSCN��Һ������ɫ�仯 4.1��4.7 ��ȥ��Һ�е�Cu2+ NH4HCO3�ֽ����ʧ ���� Zn5��OH��6��CO3��2![]() 5ZnO+2CO2��+3H2O ���ز��� 97.2% 0.17%
5ZnO+2CO2��+3H2O ���ز��� 97.2% 0.17%
��������
������п(������ͭ��������)����ϡ�����ܽ���˵õ���Һ�к�����������������ͭ������п��������������Һ������������Ϊ�����ӣ���������п������ҺpH���������Ӻ�ͭ���ӣ�����п��ԭͭ����Ϊͭ���ʣ����˵õ�����п��̼������̼����麟���п�������ɼ�ʽ̼��п�����ȷֽ����ɻ�������п��
(1)����I������25%ϡ�������98%Ũ����(�ܶ�Ϊ1.84g/mL)���ƣ��Ǵ����������ձ���ϡ�����ƣ���������������������ձ��⣬����Ҫ��������Ͳ����ͷ�ιܵȣ��ʴ�Ϊ��bd��
(2)��������Ƿ���ȫ���������������������������Һ���ɫ�����֤��ȡ������Һ���μ�KSCN��Һ������ɫ�仯˵��������ȫ�����ݳ���PH��Χ������ҺPHʹ�����Ӻ�ͭ���ӳ�����������ҺPHΪ4.1��4.7��
(3)����III�м���Zn�۵������Ǻ���ͭ���ӣ���һ��������ҺpH����ͭ���ӣ�
(4)����IV��ʹ����NH4HCO3��Һ�ܴٽ�Zn2+ת��Ϊ���������¶Ȳ��˹��ߣ���ԭ�������̼����������ֽ⣻
(5)����ֽ��������н��У���ʽ̼��п�Ļ�ѧʽΪZn5(OH)6(CO3)2���ֽ���������п��������̼��ˮ�����ԭ���غ���ƽ��д�õ���Ӧ�Ļ�ѧ����ʽΪ��Zn5(OH)6(CO3)2![]() 5ZnO+2CO2��+3H2O���ж��ѷֽ���ȫ�IJ����dz��������أ�
5ZnO+2CO2��+3H2O���ж��ѷֽ���ȫ�IJ����dz��������أ�
(6)���ݵζ���������������Һ���ʵ�������ʣ���������ʵ���������õ�������п��Ӧ���������ʵ�������õ�����п���ʵ�����������п��Ӧ�����������ʵ�����0.0150L��1.000mol/L��2��0.500mol/L��0.0120L��0.024mol��ZnO+2H+��Zn2++H2O�����㴿�ȣ�![]() ��100%��97.2%��1mL��ҺΪ25�Σ���ε����Ϊ
��100%��97.2%��1mL��ҺΪ25�Σ���ε����Ϊ![]() mL�������
mL�������![]() ��100%��0.17%��
��100%��0.17%��


 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��2A(g)+B(g)![]() 3C(g)+D(s)��H<0����������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�������ȷ����
3C(g)+D(s)��H<0����������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�������ȷ����
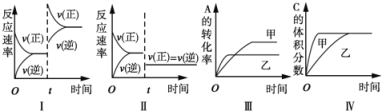
A. ͼI��ʾ���ӷ�Ӧ��Ũ�ȶԸ�ƽ���Ӱ��
B. ͼII��ʾ��Сѹǿ�Ը�ƽ���Ӱ��
C. ͼ���ʾ�¶ȶԸ�ƽ���Ӱ�죬�¶ȣ���>��
D. ͼIV��ʾ�����Ը�ƽ���Ӱ�죬��Ч�ʣ���>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����мס��ҡ�����ƿ����������Ƶ���ˮ��Ũ�Ⱦ�Ϊ0.1molL-1������ڼ�ƿ�м���������NaHCO3���壨mmol��������ƿ�м�������NaHSO3��mmol������ƿ���䣬Ƭ�̺�ס��ҡ�����ƿ��Һ��HClO�����ʵ�����Ũ�ȴ�С��ϵ�ǣ���Һ����仯���Բ��ƣ��� ��
A.��=��>��B.��>��>��C.��>��=��D.��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.1 mol��L-1�Ȼ�����Һ����������Ŀ����NA
B.25����60��ʱ��ˮ��pH���
C.�к͵�����������ʵ���Ũ�ȵ�����ʹ��������ĵ�n ( NaOH�����
D.2SO2(g)+O2(g) = 2SO3 (g)��4SO2(g)+2O2(g) = 4SO3 (g)��H���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���廯��ͭ��һ�ְ�ɫ��ĩ����������ˮ������ˮ�л���ⶼ��ֽ⣬�ڿ����л�������������ɫ��ĩ���Ʊ�CuBr��ʵ�鲽�����£�
����1.����ͼ��ʾ��������ƿ�м���45gCuSO4��5H2O��19gNaBr��150mL��й�������ˮ��60��ʱ���Ͻ��裬���ʵ�����ͨ��SO2 2Сʱ��
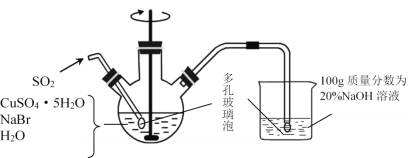
����2.��Һ��ȴ����ȥ�ϲ���Һ���ڱܹ�������¹��ˡ�
����3.��������������SO2��ˮ����������SO2���Ҵ���������ϴ�ӡ�
����4.��˫����������ֱ�װ��Ũ������������ƣ��и���3��4h���پ������������������ո��
��1��ʵ����������ˮ�辭��У����Ŀ���dz�ȥ����ˮ�е�______________��д��ѧʽ����
��2������1�У���������ƿ�з�Ӧ����CuBr�����ӷ���ʽΪ_______________��
�ڿ��Ʒ�Ӧ��60����У�ʵ���пɲ�ȡ�Ĵ�ʩ��_____________��
��˵����Ӧ����ɵ�������__________________��
��3������2������Ҫ�ܹ��ԭ����_______________��
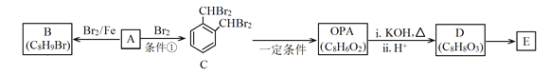
��4������3��ϴ�Ӽ���������SO2����ԭ����_____________________����ܼ��������ѵ�Ŀ����________________________________��
��5������������װ���ձ��е�����Һ���������Ҫ��Na2SO3��NaHSO3�ȣ���ȡ�ϴ�����Na2SO3��7H2O���塣�벹��ʵ�鲽�裨���õ�SO2�������ڸ�ƿ�У���20%NaOH��Һ���Ҵ���
��_______________________________________________��
��__________________________________________________��
�ۼ�������ά����C��Һ����������������Ũ������ȴ�ᾧ��
��__________________________________________________��
�ݷ���ո������и��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������ֽ��Ǧ��о��Ƶ���ʵ�飮��Ǧ��оΪ�缫���ֱ�Ӵ��������ϵ���ֽ����ͨ��Դ���۲�ʵ����������˵��������ǣ�������
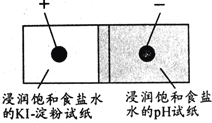
A.pH��ֽ����
B.KI��������ֽ����
C.ͨ��ʱ������ת��Ϊ��ѧ��
D.����ͨ��pH��ֽ����KI��������ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ1.00 L���ܱ������У�����һ������N2O4��������ӦN2O4(g)![]() 2NO2(g)�������¶����ߣ�����������ɫ�����ϵ�и����ʵ�Ũ�ȱ仯��ʱ���ϵ��ͼ��ʾ������˵����ȷ����
2NO2(g)�������¶����ߣ�����������ɫ�����ϵ�и����ʵ�Ũ�ȱ仯��ʱ���ϵ��ͼ��ʾ������˵����ȷ����

A.��Ӧ�ġ�H <0
B.�� 060s ʱ�Σ���Ӧ����v(N2O4)=0.001mol��L-1��s-1
C.ƽ��ʱ����Ӧ��ƽ�ⳣ��K=0.240
D.T1��ʱƽ����¶ȱ�ΪT2�������c(N2O4)���ͣ���T1>T2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2HI(g)![]() H2(g)+I2(g) ��H=Q����4�ֲ�ͬ�����½��У���֪��ʼʱI2��H2�����ʵ���Ϊ0����Ӧ��HI��Ũ�ȣ�mol/L)�淴Ӧʱ�䣨min)�ı仯������±���ʾ��
H2(g)+I2(g) ��H=Q����4�ֲ�ͬ�����½��У���֪��ʼʱI2��H2�����ʵ���Ϊ0����Ӧ��HI��Ũ�ȣ�mol/L)�淴Ӧʱ�䣨min)�ı仯������±���ʾ��
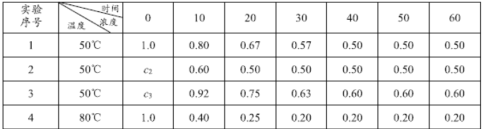
(1)ʵ��1�У���Ӧ��010 min��ƽ������v(HI)Ϊ_______mol��L-1��min-1����ϸ�����ϱ����ݿ���֪Q ______0 (����>����<������=��)��
(2)ʵ��2�У�HI�ij�ʼŨ��c2 Ϊ_____mol��L-1.��ƽ��ǰʵ��1��ƽ����Ӧ����Ϊv1��ƽ��ǰʵ��3��ƽ����Ӧ����Ϊv3����v1 ____v3 (����>����<������=��)���� c3Ϊ________mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����յ���һ�š����ṹ����ͼ��ʾ����һ�ֺϳ�Ⱦ�ϣ���ѧ��ͨ��������ѧ�о������ֳ���ʳ�ú����յ����ʳƷ������������°����ء����й��ڡ��յ���һ�š���˵��������ȷ����

A. ���ڷ����廯�������ʽΪC16H12N2O
B. �����е�����ԭ�ӿ���λ��ͬһƽ����
C. �����б����ϵ�һȡ���ﹲ��11��
D. ����NaOH��Һ��FeCl3��Һ����ˮ�����ʷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com