
| A. | 电解食盐水制烧碱 | B. | 合成氨中的催化合成 | ||
| C. | 硫酸生产中的催化氧化 | D. | 氨碱法中的氨盐水碳酸化 |
分析 二氧化硫氧化反应、硝酸工业中氨气的催化氧化、氮气与氢气的反应都需要加热,而且反应放热,在工业生产中,常常进行热交换,以充分利用能源,以此解答.
解答 解:A.氯碱工业中电解饱和食盐水是常温下的反应,不需要进行热交换,故A错误;
B.氮气与氢气的反应都需要加热,而且它们反应时会放热,所以使用热交换器可以充分利用反应所放出的热量,故B正确;
C.二氧化硫的氧化反应需在高温下进行,且反应时会放热,使用热交换器可以充分利用反应所放出的热量,故C正确;
D.氨碱法中的氨盐水碳酸化需在常温下进行,温度不能较高,防止气体挥发,故D错误.
故选BC.
点评 本题考查了几个常见工业生产的原理,侧重于化学与生产的考查,有利于培养学生良好的科学素养,注意工业反应条件,题目难度不大.


科目:高中化学 来源: 题型:实验题
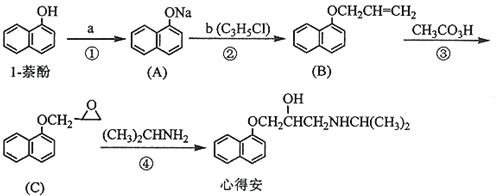
 .
. ;由F生成一硝化产物的化学方程式为
;由F生成一硝化产物的化学方程式为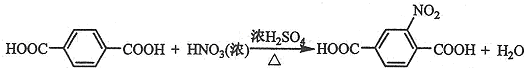 ,该产物的名称是2-硝基-1,4-苯二甲酸.
,该产物的名称是2-硝基-1,4-苯二甲酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石 | |
| B. | 居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 | |
| C. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| D. | 某雨水样品放置一段时间后pH由4.68变为4.28,是因为吸收了CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Zn为电池的负极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
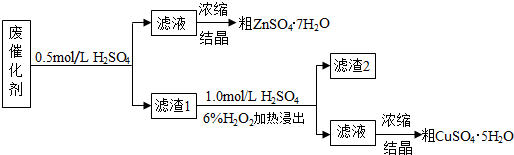

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
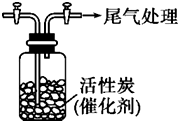 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
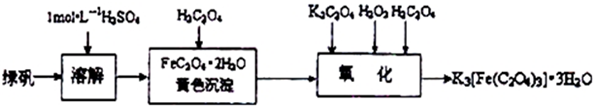
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要意义.
研究CO2的利用对促进低碳社会的构建具有重要意义. CO(NH2)2+H2O.时氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.
CO(NH2)2+H2O.时氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com