
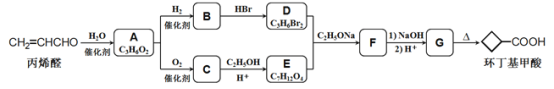
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸(部分反应条件、产物巳省略)。
已知:
请回答下列问题:
(1)由丙烯醛生成化合物A的反应类型为____________
(2)化合物C的结构简式是________________________
(3)下列说法中不正确的是____________(填字母代号)。
A.化合物A能与 NaHCO3溶液反应
B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4
D.1mol化合物B与足量金属钠反应能牛成1mol氢气
(4)写出D+E→F的化学方程式:___________________________________
(5)环丁基甲酸与苯酚反应生成一种酯X,化合物X满足下列条件的所同分异构体有____________种,写出其中一种的结构简式:________________________
①能使FeCl3溶液变紫色;
②含有丙烯醛中所有的官能团;
③1H-NMR谱显示分子中含有5种不同化学环境的氢原子
(6)以1,3-丁二烯和化合物E为原料可制备环戊基甲酸![]() ,请选用必要的试剂设计合成路线____________________________________________________________
,请选用必要的试剂设计合成路线____________________________________________________________
【答案】 加成反应 HOOCCH2COOH A  3
3  、
、 、
、

【解析】根据流程图,丙烯醛(CH2=CHCHO)与水反应生成A,A的化学式为C3H6O2,则发生了加成反应,A氧化生成C,C与乙醇在酸性条件下发生酯化反应生成E,根据E的化学式,说明C为二元羧酸,则C为HCOOCCH2COOH,A为HOCH2CH2CHO,E为CH3CH2OOCCH2COOCH2CH3;A与氢气发生还原反应生成B,B与HBr反应生成二溴代烃,则B为二元醇即HOCH2CH2CH2OH,D为BrCH2CH2CH2Br,根据已知信息,D和E反应生成F,F为 ,F在碱性条件下水解后酸化生成G,G为
,F在碱性条件下水解后酸化生成G,G为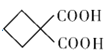 ,根据已知信息G受热脱去一个羧基生成环丁基甲酸。(1)丙烯醛与氢气发生加成反应生成化合物A(HOCH2CH2CHO),反应类型为加成反应;(2)化合物C的结构简式是HCOOCCH2COOH;(3)A.化合物A为HOCH2CH2CHO,不能与 NaHCO3溶液反应,选项A错误;B.化合物B为HOCH2CH2CH2OH,化合物C为HCOOCCH2COOH,能发生缩聚反应形成高聚物,选项B正确;C.化合物G为
,根据已知信息G受热脱去一个羧基生成环丁基甲酸。(1)丙烯醛与氢气发生加成反应生成化合物A(HOCH2CH2CHO),反应类型为加成反应;(2)化合物C的结构简式是HCOOCCH2COOH;(3)A.化合物A为HOCH2CH2CHO,不能与 NaHCO3溶液反应,选项A错误;B.化合物B为HOCH2CH2CH2OH,化合物C为HCOOCCH2COOH,能发生缩聚反应形成高聚物,选项B正确;C.化合物G为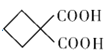 ,化学式为C6H8O4,选项C正确;D. 化合物B为HOCH2CH2CH2OH,1mol化合物B与足量金属钠反应能牛成1mol氢气,选项D正确。答案选A;(4)D+E→F的化学方程式为:
,化学式为C6H8O4,选项C正确;D. 化合物B为HOCH2CH2CH2OH,1mol化合物B与足量金属钠反应能牛成1mol氢气,选项D正确。答案选A;(4)D+E→F的化学方程式为: ; (5)环丁基甲酸与苯酚反应生成一种酯X,化合物X满足条件:①能使FeCl3溶液变紫色,说明含有酚羟基;②含有丙烯醛中所有的官能团,即含有碳碳双键和醛基;③1H-NMR谱显示分子中含有5种不同化学环境的氢原子。满足条件的X有:
; (5)环丁基甲酸与苯酚反应生成一种酯X,化合物X满足条件:①能使FeCl3溶液变紫色,说明含有酚羟基;②含有丙烯醛中所有的官能团,即含有碳碳双键和醛基;③1H-NMR谱显示分子中含有5种不同化学环境的氢原子。满足条件的X有:  、
、 、
、 共3种;(6)以1,3-丁二烯和CH3CH2OOCCH2COOCH2CH3为原料可制备环戊基甲酸
共3种;(6)以1,3-丁二烯和CH3CH2OOCCH2COOCH2CH3为原料可制备环戊基甲酸![]() ,根据题干流程图提供的信息,可以用1,3-丁二烯首先制备二溴代烃,再与化合物E反应生成
,根据题干流程图提供的信息,可以用1,3-丁二烯首先制备二溴代烃,再与化合物E反应生成 ,然后水解生成
,然后水解生成 ,最后加热脱羧
,最后加热脱羧 ,合成路线为:
,合成路线为: 。
。


科目:高中化学 来源: 题型:
【题目】(1)工业上用洗净的废铜屑作原料来制备硫酸铜。下列制备方法符合“绿色化学”思想的是_________(填序号)。
①![]() ②
②![]()
写出①中反应的化学方程式:_____________________。
(2)SO2被称为“空中死神”,其对环境的危害常表现为__________________。为了减少危害,人们进行了许多有益的探索和研究,并且在实际应用上取得了一定的成果。工业上常用生石灰来处理煤炭中的SO2,这是利用了SO2属于__________氧化物的性质。
(3)硫元素是一种常见的非金属元素,硫原子的原子结构示意图为_______,自然界中存在的某种单质以八个原子结合,其分子式为_______。
(4)氮元素是大气中含量最高的元素,其单质的电子式___________。由于该单质比较稳定,只能与部分活泼金属反应,比如在点燃条件下,可与金属镁反应,试写出该反应方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是

A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中![]()
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂和氮的相关化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题
(1)Li的氢标电势是最负的,达到-3.045V,与水有很大的反应倾向,然而将Li单质加入水中,其反应烈程度远不如其他碱金属,试解释原因___________________________
(2)基态氮原子中,核外电子占据的最高能层的符号为____________,核外电子能量最高的电子的电子云轮廓图形状为____________
(3)氮元素既可与其他元素形成正离子,比如N2O5结构中存在NO2+的结构,其空间构型为____________,氮原子的杂化形式为____________;它也可以形成全氮的正离子,比如 N5AsF6中存在高能量的N5+,N5+的空间构型为____________。
(4)下图为一种N和Li形成的二元化合物的晶体结构,试在图中划出其晶胞__________,该化合物的化学式为____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定FeSO4溶液置于空气中是否变质,所选检验试剂能达到目的是( )
A. NaOH溶液 B. KSCN溶液 C. BaCl2溶液 D. 硝酸钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 所有细胞中的化合物的含量是一样的
B. 所有细胞中化合物的种类都一样
C. 各种细胞中的元素种类完全一致
D. 细胞中都有蛋白质和核酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.形成离子键的阴、阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第3周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国在航空航天事业上取得了令人瞩目的成就,科学家在能量的转化,航天器的零排放作出了很大的努力,其中为了达到零排放的要求,循环利用人体呼出的CO2并提供O2,设计了一种装置(如图)实现了能量的转化。总反应方程式为2CO2=2CO+O2。关于该装置下列说法正确的是

A. 装置中离子交换膜为阳离子交换膜
B. CO2参与X电极的反应方程式:CO2+2e-+H2O=CO+2OH-
C. N型半导体为正极,P型半导体为负极
D. 外电路每转移2mol电子,Y极生成气体22.4L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com