
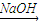 Mg(OH)2
Mg(OH)2 Mg
Mg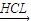 MgCl2溶液→MgCl2
MgCl2溶液→MgCl2 Mg
Mg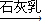 Mg(OH)2
Mg(OH)2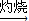 MgO
MgO Mg
Mg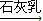 Mg(OH)2
Mg(OH)2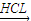 MgCl2溶液→MgCl2
MgCl2溶液→MgCl2 Mg
Mg

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
已知有关物质的溶、沸点数据如下表所示:
| 化合物 | MgO | Al2O3 | MgCl 2 | AlCl3 |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5*105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融MgCl 2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
答:__________________________________________________________________
(2)氯化铝是________________(填晶体类型)
(3)在500K和1.01*105Pa时,氯化铝的蒸气密度(换算为标准状况时)为11.92g/L,试确定氯化铝在蒸气状态时的化学式为___________________
(4)无水氯化铝在空气中剧烈“发烟”,其原因是________________
(5)设计可靠的实验证明MgCl 2、AlCl3所属的晶体类型,其实验方法是_____________.
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 实验 编号 |
T/K | 反应 时间/h |
反应物的物质的量配比 n[CO(NH的)的]:n[MgCl的?6H的O] |
实验目的 |
| ① | 3二8 | 3 | 3:w | (Ⅰ)实验①和③探究______ ______; (Ⅱ)实验②和④探究______; (Ⅲ)实验②和______探究反应时间对产率的影响. |
| ② | 3二8 | 4 | 4:w | |
| ③ | 3二8 | 3 | ||
| ④ | 3多8 | 4 | 4:w |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com