
| A. | 第ⅢA族 | B. | 第ⅠA族 | C. | 镧系元素 | D. | 第ⅢB族 |
分析 短周期时,原子序数为x的元素位于周期表中的第ⅡA族,原子序数为x+1的元素在第ⅢA族,在四、五周期时,元素在ⅢB族,在六、七周期时,为镧系或锕系元素,以此来解答.
解答 解:短周期时,原子序数为x的元素位于周期表中的第ⅡA族,原子序数为x+1的元素在第ⅢA族;
在四、五周期时,原子序数为x的元素位于周期表中的第ⅡA族,则原子序数为x+1的元素在ⅢB族;
在六、七周期时,原子序数为x的元素位于周期表中的第ⅡA族,则原子序数为x+1的元素为镧系或锕系元素,
则不可能为ⅠA族元素,
故选B.
点评 本题考查元素周期表的结构,为高频考点,熟悉元素周期表的结构及元素在周期表的位置来解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液鉴别乙烯和乙炔 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸进行酸化 | |
| C. | 酒精与稀硫酸加热到170℃制乙烯 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
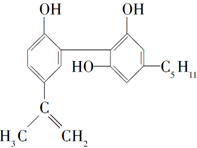 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )| A. | 它的化学式为C19H26O3 | |
| B. | 该化合物只能发生取代反应 | |
| C. | 从结构上看,它属于醇类 | |
| D. | 从元素组成上看,它可以在氧气中燃烧生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由Z、M两种元素形成化合物的分子式一定为M2Z | |
| D. | 由 X、Y、Z、M 四种元素形成的化合物可以既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
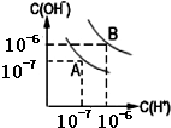 (1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物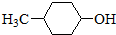 的消去产物有两种 的消去产物有两种 | |
| C. | 有机物C4H6O2能发生加聚反应,可推知其结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别苯酚、四氯化碳和乙酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com