
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 使甲基橙变红色的溶液:Mg2+、K+、SO42﹣、NO3﹣
B. 使酚酞变红色的溶液:Na+、Cu2+、HCO3﹣、NO3﹣
C. 0.1 mol•L﹣1AgNO3溶液:H+、K+、SO42﹣、I﹣
D. 0.1 mol•L﹣1NaAlO2溶液:H+、Na+、Cl﹣、SO42﹣
考点: 离子共存问题.
专题: 离子反应专题.
分析: A.使甲基橙变红色的溶液,pH<3.1,溶液显酸性;
B.使酚酞变红色的溶液,pH>8,溶液显碱性;
C.AgI为黄色沉淀;
D.AlO2﹣、H+反应.
解答: 解:A.使甲基橙变红色的溶液,pH<3.1,溶液显酸性,该组离子之间不反应,能共存,故A正确;
B.使酚酞变红色的溶液,pH>8,溶液显碱性,Cu2+、HCO3﹣分别与碱反应,则不能共存,故B错误;
C.Ag+、I﹣结合生成AgI为黄色沉淀,Ag+、SO42﹣结合生成沉淀,则不能共存,故C错误;
D.AlO2﹣、H+反应时,酸少量生成沉淀,酸过量时生成铝离子,则不能共存,故D错误;
故选A.
点评: 本题考查离子的共存,明确习题中的信息及离子之间的反应是解答本题的关键,注意酸碱指示剂的变色范围为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁晶体和金属铜.请根据如下回收流程图,回答有关问题: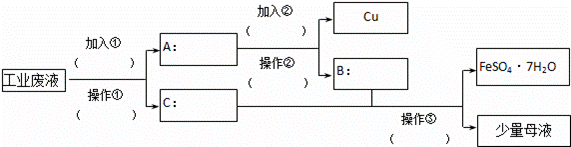
(1)加入①为 ,加入②为 (要考虑用量).
(2)操作②的名称为 .
(3)母液中含有的离子有(填离子符号): .
(4)为了得到纯净的FeSO4•7H2O晶体,操作③在蒸发、冷却结晶后还要洗涤FeSO4•7H2O晶体,洗涤FeSO4•7H2O晶体的方法是:
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生:一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是()

A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl﹣═Cl2↑+H2↑
B. 断开K1,闭合K2时,石墨电极作正极
C. 断开K2,闭合K1时,石墨电极附近溶液变红
D. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e﹣═2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
完成下列各题:
(1)正四面体烷的分子式为C4H4,其二氯取代产物有 种.
(2)关于乙烯基乙炔分子的说法错误的是: ;
a.能使酸性KMnO4溶液褪色
b.1mol乙烯基乙炔能与3mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式 .
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例): 、 .

查看答案和解析>>
科目:高中化学 来源: 题型:
实验室将NaClO3和Na2SO3按物质的量之比1:2倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为()
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是()
A. 该溶液中,K+、Fe2+、C6H5OH、Br﹣可以大量共存
B. 和KI溶液反应的离子方程式:Fe3++2I﹣═Fe2++I2
C. 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42﹣+Ba2++3OH﹣═Fe(OH)3↓+BaSO4↓
D. 1L O.1mol•L﹣1该溶液和足量的Zn充分反应,生成11.2g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
某待测溶液(阳离子为Na+)中可能含有SO42﹣、SO32﹣、NO3﹣、C1﹣、Br﹣、S2﹣、CO32﹣、HCO3﹣中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题:
(1)待测液中是否含有SO42﹣、SO32﹣: .
(2)沉淀B的化学式为 ;生成沉淀B的离子方程式为 .
(3)根据以上实验,待测液中肯定没有的离子是 ;肯定存在的离子还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是()
A. 等体积pH=3的酸溶液和pH=11的碱溶液相互混合后,溶液的pH一定等于7(25℃)
B. 固态磷酸是电解质,所以磷酸在熔化时或溶解于水时都能导电
C. 锌与pH=3的CH3COOH 溶液反应比pH=4 的盐酸反应剧烈
D. 在0.1 mol/L Na2CO3溶液中,2c(Na+)=c(H2CO3)+c(CO32﹣)+c(HCO3﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
铁单质及其化合物在生活、生产中应用广泛.请回答下列问题:
(1)由于氧化性Fe3+>Cu2+,氯化铁溶液常用做印刷电路铜板腐蚀剂,反应的离子方程式是 .
(2)硫酸铁可做絮凝剂,常用于净水,其原理是
(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是 .
(3)磁铁矿冶炼铁的原理是Fe3O4+4CO=3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移的电子的物质的量是 .
(4)表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
选项 陈述Ⅰ 陈述Ⅱ 判断
A 铁是地壳中含量最高的金属元素 铁是人类最早使用的金属材料 Ⅰ对;Ⅱ对;有
B 常温下铁与稀硫酸反应生成氢气 高温下氢气能还原氧化铁得到铁 Ⅰ对;Ⅱ对;无
C 铁属于过渡元素 铁和铁的某些化合物可用做催化剂 Ⅰ错;Ⅱ对;无
D 在空气中铁的表面能形成致密的氧化膜 铁不能与氧气反应 Ⅰ对;Ⅱ对;有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com