
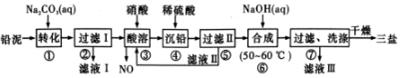
分析 向铅泥中加入Na2CO3溶液,PbSO4转化为难溶PbCO3的离子方程式为CO32-+PbSO4=PbCO3+SO42-,然后过滤得到滤液Ⅰ为Na2SO4溶液,向滤渣中加入硝酸酸溶,PbO、Pb、PbCO3都与硝酸反应生成Pb(NO3)2,Pb与硝酸反应还生成NO,铅与硝酸生成Pb(NO3)2及NO的离子方程式为3Pb+8H++2NO3-=3Pb+2NO↑+4H2O,然后向溶液中加入硫酸,生成bSO4沉淀,过滤,滤液Ⅱ的主要成分是HNO3,向滤渣中加入NaOH溶液,发生反应4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O,过滤洗涤干燥得到3PbO•PbSO4•H2O,滤液Ⅲ中含有Na2SO4,以此解答该题.
解答 解:(1)铅蓄电池在充电时,阳极发生氧化反应,PbSO4被氧化生成PbO2,电极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,若铅蓄电池放电前正、负极质量相等,放电时正极发生,PbO2(s)+2e-+SO42-(aq)+4H+(aq)=PbSO4(s)+2H2O(l),负极发生Pb-2e-+SO42-=PbSO4,转移了lmol电子,则正极、负极都生成0.5molPbSO4,正极质量增加m(PbSO4)-m(PbO2)=0.5mol×(303g/mol-239g/mol)=32g,正极质量增加m(PbSO4)-m(Pb)=0.5mol×(303g/mol-207g/mol)=48g,
则两极质量差为48g-32g=16g,
故答案为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+;16g;
(2)通过以上分析知,滤液Ⅰ和滤液Ⅲ经脱色、蒸发、结晶可得到的副产品为Na2SO4•10H2O,其相对分子质量为322,故答案为:Na2SO4•10H2O;
(3)通过以上分析知,该离子反应方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O,滤液2中主要成分是未反应的HNO3,
故答案为:3Pb+8H++2NO3-=3Pb2++2NO+4H2O;HNO3;
(4)该反应方程式为4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O,故答案为:4PbSO4+6NaOH=3PbO•PbSO4•H2O+3Na2SO4+2H2O;
(5)该沉淀吸附的离子是硫酸根离子,用盐酸酸化的氯化钡检验,其检验方法为取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全,
故答案为:取少量最后一次洗涤后的滤液于试管中,滴加BaCl2溶液和稀盐酸,若产生白色沉淀,则沉淀末洗涤完全;若没有白色沉淀生成,则沉淀已洗涤完全.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析及知识综合应用能力,涉及基本操作、氧化还原反应、离子反应等知识点,明确流程图中发生的反应或操作方法是解本题关键,注意基础知识的积累和灵活运用,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色 | 氧化性:Cl2>Br2 |
| B | 室温下,向浓度均为0.1moL•L-1的KCl和KI混合溶液中滴加几滴AgNO3溶液,只出现黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| C | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
| D | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧得到固体残留物 | 该固体为NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Cu2+与NH3形成配合物时的配位数 | |
| B. | NaCl的晶格能与MgO的晶格能 | |
| C. | H-F键的极性与H-O键的极性 | |
| D. | BF3的键角CS2的键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y<Z<W | |
| B. | 原子最外层电子数:W>Z>Y | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 由X、Y、Z三种元素形成的化合物的水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
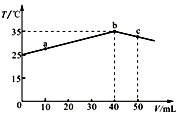
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高压钠灯能发出透雾能力强的淡紫色光,常用做路灯 | |
| B. | 用水清洗盛装过浓硫酸的铁捅要远离火源 | |
| C. | 理电池应用广泛,是因为锉能直接与水反应,不需要特殊的电解质溶液 | |
| D. | 据报导,一定条件下氢气可转变为金属氢,金属氢具备超导等优良性能.由氢气转变为金属氢属于同一元索的同位素之间的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
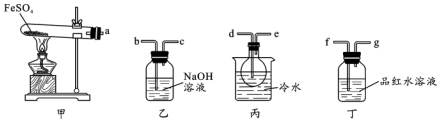
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+)>c(CH3COOH) | B. | c(CH3COOH)>c(Na+)>c(CH3COO-) | ||
| C. | c(Na+)>c(CH3COO-)>c(CH3COOH) | D. | c(CH3COO-)>c(CH3COOH)>c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com