
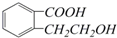 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: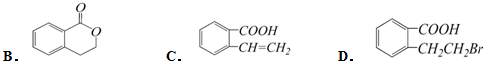
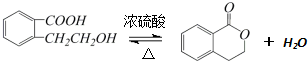 .
. 科目:高中化学 来源: 题型:选择题
| A. | 将苯与浓硝酸、浓硫酸的混合物在60℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾可以检验CH2=CH-CHO中碳碳双键 | |
| C. | 将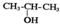 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| D. | 向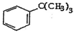 中通入足量的酸性高锰酸钾溶液可以得到 中通入足量的酸性高锰酸钾溶液可以得到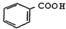 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的球棍模型示意图为: | B. | 乙烯的实验式为:CH2 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | 2-乙基-1,3-丁二烯分子的键线式: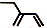 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| B. | 物质发生化学变化一定伴随着能量变化,且能量形式只表现为热量变化 | |
| C. | 把石墨完全转化为金刚石时,要吸收能量,所以石墨不如金刚石稳定 | |
| D. | 原子结合成分子的过程一定释放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族元素的金属性比第IIA族元素的金属性强 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA元素 | |
| C. | 碱金属的熔点和密度都是随着原子序数的增大而增大 | |
| D. | 如果发现了原子序数为117号元素,它应该属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
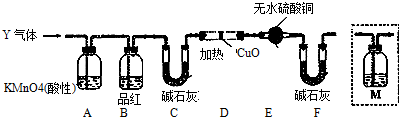
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 26.04 |
| 2 | 0.3000 | 2.00 | 25.02 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com