
如图所示的原电池装置
(1)金属Zn组成的电极是 极,发生 反应,电极反应方程式为 ;
(2)金属Cu电极反应方程式为 .
(3)当导线上通过3.01×1022个电子时,锌片质量减少 g,铜片表面析出氢气 L(标准状况).

考点:
原电池和电解池的工作原理.
专题:
电化学专题.
分析:
(1)在用锌片、铜片和稀硫酸组成的原电池装置中,锌片的活泼性大于铜片的活泼性,所以锌片作负极,负极上锌失电子发生氧化反应;
(2)铜片作正极,正极上氢离子得电子发生还原反应;
(3)根据电极反应式,利用电子与反应物之间的关系求算.
解答:
解:(1)该装置中,活泼性较强的金属锌作负极,锌失电子发生氧化反应,电极反应式为:Zn﹣2e﹣═Zn2+;
故答案为:负;氧化;Zn﹣2e﹣═Zn2+;
(2)该装置中,活泼较弱的铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e﹣═H2↑;
故答案为:2H++2e﹣═H2↑;
(2)已知负极的电极反应式为Zn﹣2e﹣=Zn2+,当导线上通过3.01×1022个电子时,则电子的物质的量为0.05mol,则n(Zn)=0.025mol,所以锌片质量减少为:0.025mol×65g/mol=1.625g,金属Cu电极反应方程式为2H++2e﹣═H2↑,则Cu电极上生成的氢气为:n(H2)=0.025mol,
所以V(H2)=0.025mol×22.4L/mol=0.56L;
故答案为:1.625; 0.56.
点评:
本题考查了原电池原理,主要涉及了电极的判断、电极方程式的书写、根据转移的电子求算有关物质等,侧重于基础知识的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.分散质粒子的大小
C.是否能通过滤纸
D.是否均一、透明、稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,其中Na2SO3被氧化为Na2SO4.在以上反应中,NaClO3和Na2SO3的物质的量之比为( )
|
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应NaClO+2HCl=NaCl+H2O+Cl2↑,被氧化的氯原子与被还原的氯原子之比是( )
|
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用Na2SO3还原MnO4﹣,如果还原含有2.4×10﹣3 mol MnO4﹣的溶液时,消耗30mL0.2mol•L﹣1的Na2SO3溶液,则Mn元素在还原产物中化合价为( )
|
| A. | +1 | B. | +2 | C. | +4 | D. | +5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是()
A. 1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B. 常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数为3NA
C. 0.1 mol•L﹣1 NaF溶液中,HF和F﹣总和为0.1NA个
D. 12.5 mL 16 mol•L﹣1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)⇌MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是()
选项 x y
A 温度 容器内混合气体的密度
B CO的物质的量 CO2与CO的物质的量之比
C SO2的浓度 平衡常数K
D MgSO4的质量(忽略体积) CO的转化率
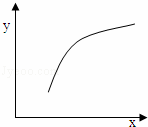
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
关于元素周期表的下列叙述,错误的是( )
|
| A. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一 |
|
| B. | 在周期表中,把电子层数相同的元素排成一横行,称为一周期 |
|
| C. | 元素周期表中,总共有18个纵行,18个族 |
|
| D. | 第IA族的元素又称为碱金属元素(除了H),第VIIA族的元素又称为卤族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
|
| A. | 分子组成为C4H100的醇有4种 |
|
| B. | 1 mol二氯乙烷与Cl2发生取代反应,反应完全共需4 mol Cl2 |
|
| C. | (CH3)3CCH2CH3的一氯代物有3种 |
|
| D. | 乙烷与Cl2反应与乙烯与C12的反应类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com