


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
| 编号 | 名称 | 原理 |
| 方法一 | 尿素法 | 在温度70-95℃时,尿素溶液吸收NO、NO2,将其转化为N2 |
| 方法二 | 选择性催化还原( SCR)法 | 以NH3等作为还原剂,将烟气中的NOx还原生成N2和H2O |
| 方法三 | 电学法 | 以连二亚硫酸盐为氧化还原中介剂,将NOx还原为N2和N2O,连二亚硫酸盐被氧化成SO32-,经电化学还原而重复使用.采用内电池模式将SO2氧化为硫酸,在外电池模式时,电池可再生 |
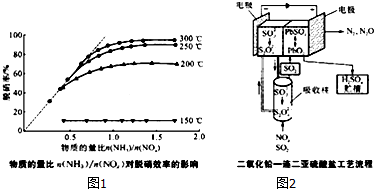
查看答案和解析>>
科目:高中化学 来源: 题型:
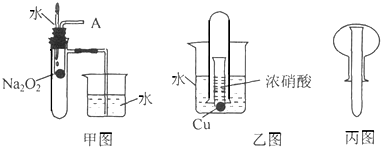
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、①③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
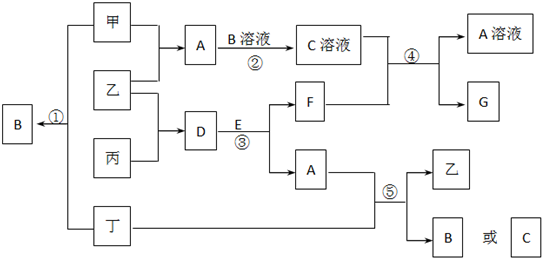
查看答案和解析>>
科目:高中化学 来源: 题型:
 +H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化.
+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
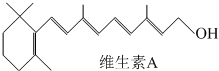
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-1 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B、95℃纯水的pH<7,说明加热可导致水呈酸性 |
| C、pH=3的醋酸溶液,稀释至10倍后pH=4 |
| D、0.02mol/L的盐酸,与等体积水混合后pH=2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com