
ŅŃÖŖ¶ĻĮŃ1 mol C”ŖH¼ü£¬ŅŖĪüŹÕČČĮæ414.4 kJ£»¶ĻĮŃ1 mol C”ŖC¼ü£¬ŅŖĪüŹÕČČĮæ347.4 kJ£»Éś³É1 mol C===C¼ü£¬»į·Å³öČČĮæ615.3 kJ£»Éś³É1 mol H”ŖH¼ü£¬»į·Å³öČČĮæ435.3 kJ£¬Ä³ÓŠ»śĪļ·Ö½āµÄ·“Ó¦æɱķŹ¾ĪŖ£ŗ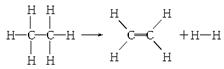
ČōŌŚ·“Ó¦ÖŠĻūŗÄĮĖ1 molŅŅĶ飬ŌņÓŠ¹ŲøĆ·“Ó¦µÄĖµ·ØÕżČ·µÄŹĒ(””””)
| A£®øĆ·“Ó¦·Å³ö251.2 kJµÄČČĮæ | B£®øĆ·“Ó¦ĪüŹÕ251.2 kJµÄČČĮæ |
| C£®øĆ·“Ó¦·Å³ö125.6 kJµÄČČĮæ | D£®øĆ·“Ó¦ĪüŹÕ125.6 kJµÄČČĮæ |

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ÅšŗĶĆ¾ŠĪ³ÉµÄ»ÆŗĻĪļĖ¢ŠĀĮĖ½šŹō»ÆŗĻĪļ³¬µ¼ĪĀ¶ČµÄ×īøß¼ĒĀ¼”£ČēÓŅĶ¼ŹĒøĆ»ÆŗĻĪļµÄ¾§Ģå½į¹¹µ„ŌŖ£ŗĆ¾Ō×Ó¼äŠĪ³ÉÕżĮłĄāÖł£¬ĒŅĄāÖłµÄÉĻĻĀĆę»¹ø÷ÓŠŅ»øöĆ¾Ō×Ó£»6øöÅšŌ×ÓĪ»ÓŚĄāÖłµÄ²ąĄāÉĻ£¬ŌņøĆ»ÆŗĻĪļµÄ»ÆѧŹ½æɱķŹ¾ĪŖ( )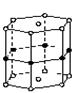
| A£®MgB | B£®Mg3B2 |
| C£®MgB2 | D£®Mg2B3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŃÖŖĻĀĮŠ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ”÷H1
2 H2(g)+O2(g)=2H2O(g) ”÷H2
C(s)+O2(g)=CO2(g) ”÷H3
Ōņ·“Ó¦4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)µÄ”÷HĪŖ£Ø £©
| A£®12”÷H3+5”÷H2£2”÷H1 | B£®2”÷H1£5”÷H2£12”÷H3 |
| C£®12”÷H3£5”÷H2£2”÷H1 | D£®”÷H1£5”÷H2£12”÷H3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŃÖŖ·“Ó¦A+B=C+DµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ £Ø £©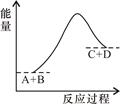
| A£®øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦ |
| B£®øĆ·“Ó¦ĪŖĪüČČ·“Ó¦ |
| C£®·“Ó¦ĪļµÄ×ÜÄÜĮæøßÓŚÉś³ÉĪļµÄ×ÜÄÜĮæ |
| D£®øĆ·“Ó¦Ö»ÓŠŌŚ¼ÓČČĢõ¼žĻĀ²ÅÄܽųŠŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŃÖŖ£ŗ2CO(g)+O2(g)=2CO2(g) ¦¤H= £566 kJ?mol£1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ¦¤H= £226 kJ?mol£1
ĻĀĮŠ±ķŹöÕżČ·µÄŹĒ(NA“ś±ķ°¢·üŁ¤µĀĀŽ³£ŹżµÄŹżÖµ) ( )
| A£®1molCOČ¼ÉÕŹ±·Å³öµÄČČĮæĪŖ283 kJ?mol£1 |
| B£®Na2O2(s)+CO(g) = Na2CO3(s)¦¤H= £509 kJ?mol-1 |
| C£®Na2O2(s)ÓėCO2(g)·“Ó¦·Å³ö226 kJČČĮæŹ±µē×Ó×ŖŅĘŹżĪŖ2NA |
| D£®Na2O2ŗĶNa2CO3ÖŠŅõŃōĄė×ÓøöŹż±Č²»Ķ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŃÖŖ¶ĻĮŃ1 mol C”ŖH¼ü£¬ŅŖĪüŹÕČČĮæ414.4 kJ£»¶ĻĮŃ1 mol C”ŖC¼ü£¬ŅŖĪüŹÕČČĮæ347.4 kJ£»Éś³É1 mol C===C¼ü£¬»į·Å³öČČĮæ615.3 kJ£»Éś³É1 mol H”ŖH¼ü£¬»į·Å³öČČĮæ435.3 kJ£¬Ä³ÓŠ»śĪļ·Ö½āµÄ·“Ó¦æɱķŹ¾ĪŖ£ŗ
ČōŌŚ·“Ó¦ÖŠĻūŗÄĮĖ1 molŅŅĶé(·“Ó¦Īļ)£¬ŌņÓŠ¹ŲøĆ·“Ó¦µÄĖµ·ØÕżČ·µÄŹĒ(””””)
| A£®øĆ·“Ó¦·Å³ö251.2 kJµÄČČĮæ | B£®øĆ·“Ó¦ĪüŹÕ251.2 kJµÄČČĮæ |
| C£®øĆ·“Ó¦·Å³ö125.6 kJµÄČČĮæ | D£®øĆ·“Ó¦ĪüŹÕ125.6 kJµÄČČĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŃÖŖ25 ”ę”¢101 kPaĻĀ£¬ĻĀĮŠ·“Ó¦
C(ŹÆÄ«) + O2(g) === CO2(g) £¬Č¼ÉÕ1 mol C(ŹÆÄ«)·ÅČČ393.51 kJ”£
C(½šøÕŹÆ) + O2(g) === CO2(g)£¬Č¼ÉÕ1 mol C(½šøÕŹÆ)·ÅČČ395.41 kJ”£
æÉŅŌµĆ³öµÄ½įĀŪŹĒ
| A£®½šøÕŹÆ±ČŹÆÄ«ĪČ¶Ø | B£®1 molŹÆÄ«Ėł¾ßÓŠµÄÄÜĮæ±Č1 mol½šøÕŹÆµĶ |
| C£®½šøÕŹÆ×Ŗ±ä³ÉŹÆÄ«ŹĒĪļĄķ±ä»Æ | D£®ŹÆÄ«ŗĶ½šøÕŹÆ¶¼ŹĒĢ¼µÄĶ¬Ī»ĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŌŚ101kPa 25”ꏱ£¬1.0gŅŅĶéĘųĢåĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®Ź±·Å³öČČĮæ52.0kJ£¬ŌņŅŅĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ
A£®C2H6(g) £« 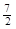 O2(g)£½2CO2(g) £«3H2O(l)”÷H =£1560kJ”¤mol£1 O2(g)£½2CO2(g) £«3H2O(l)”÷H =£1560kJ”¤mol£1 |
| B£®2C2H6(g) £« 7O2(g)£½4CO2(g) £«6H2O(g)”÷H =£1560kJ”¤mol£1 |
| C£®2C2H6(g) £« 7O2(g)£½4CO2(g) £«6H2O(l)”÷H =£«3120 kJ”¤mol£1 |
D£®C2H6(g) £«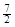 O2(g)£½2CO2(g) £«3H2O(l)”÷H =£52.0kJ”¤mol£1 O2(g)£½2CO2(g) £«3H2O(l)”÷H =£52.0kJ”¤mol£1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
Ēā·śĖįŹĒŅ»ÖÖČõĖį£¬æÉÓĆĄ“æĢŹ“²£Į§”£ŅŃÖŖ25 Ź±£ŗ
Ź±£ŗ
ŌŚ20Ml0.lmol/LµÄĒā·śĖįÖŠµĪ¼Ó0.lmol/LµÄNaOH V mL£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®Ēā·śĖįµÄµēĄė·½³ĢŹ½¼°ČČŠ§Ó¦æɱķŹ¾ĪŖ£ŗ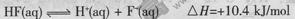 |
B£®µ±V="20" mLŹ±£¬ČÜŅŗÖŠ£ŗ |
C£®µ±V="20" mLŹ±£¬ČÜŅŗÖŠ£ŗ |
D£®µ±v>0Ź±£¬ČÜŅŗÖŠŅ»¶Ø“ęŌŚ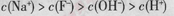 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com