
分析 (1)一定条件下,充入2.0mol SO2(g) 和2.0mol O2(g),20s后达平衡,测得SO3的体积分数为12.5%,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 2 0
变化量(mol):2x x 2x
平衡量(mol):2-2x 2-x 2x
故$\frac{2-2x}{4-x}$=12.5%,解得x=0.8,再根据v=$\frac{△c}{△t}$计算v(SO2);
(2)化学平衡常数是平衡时生成物浓度幂之积比反应物浓度幂之积,所以K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$计算平衡常数;若降温平衡常数增大,则平衡正向移动,正反应为放热反应;
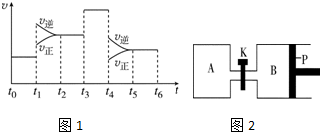
(3)如图1表示该反应的速率(v)随时间(t)的变化的关系:据图分析:t3时正逆反应速率同等程度增大,而反应前后两边的计量数不等,所以t3时使用催化剂;t6时保持体积不变向体系中充入少量He气,各组分的浓度不变,平衡不移动;
(4)根据恒温恒压条件下,气体的物质的量之比等于容器的容积之比计算出消耗的三氧化硫的物质的量;根据等效平衡的知识判断6mol三氧化硫达到平衡时容器的体积,然后计算出打开K后容器B的体积.
解答 解:(1)一定条件下,充入2.0mol SO2(g) 和2.0mol O2(g),20s后达平衡,测得SO3的体积分数为12.5%,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 2 0
变化量(mol):2x x 2x
平衡量(mol):2-2x 2-x 2x
故$\frac{2-2x}{4-x}$=12.5%,解得x=0.8,v(SO2)=$\frac{△c}{△t}$=$\frac{\frac{2×0.8mol}{2L}}{20s}$=0.04mol/(L•s),故答案为:0.04;
(2)化学平衡常数是平衡时生成物浓度幂之积比反应物浓度幂之积,所以K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$;若降温平衡常数增大,则平衡正向移动,正反应为放热反应,故答案为:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$;<;
(3)如图1表示该反应的速率(v)随时间(t)的变化的关系:据图分析:t3时正逆反应速率同等程度增大,而反应前后两边的计量数不等,所以t3时使用催化剂;t6时保持体积不变向体系中充入少量He气,各组分的浓度不变,平衡不移动,故答案为:催化剂;不;
(4)①反应达到平衡时容器B的体积为1.2a L,B为恒压条件下,容器的容积与气体的物质的量成正比,说明达到平衡时气体的物质的量为反应前的1.2倍,即平衡时混合气体的物质的量为2.4mol,气体物质的量之间了0.2mol,设反应消耗了三氧化硫nmol,则
2SO3(g)?2SO2(g)+O2(g)△n
2 2 1 1mol
n 0.4mol
n=0.8mol,三氧化硫的转化率为:$\frac{0.8mol}{2mol}$×100%=40%,
故答案为:40%;
②若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中进入6mol三氧化硫达到的平衡为等效平衡,所以达到平衡时整个容器的容积为:$\frac{6mol}{2mol}$×1.2a=3.6a,所以容器B的体积为:3.6a-a=2.6a,
故答案为:2.6a.
点评 本题考查了化学平衡的计算知识,题目难度不大,充分反映学生对所学知识的掌握情况.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 不慎打翻燃着的酒精灯,立即用湿抹布盖灭 | |
| B. | 金属钠着火时,立即用泡沫灭火器进行灭火 | |
| C. | 给盛有液体的试管加热时,要不断移动试管或加人碎瓷片 | |
| D. | 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油能使溴的四氯化碳溶液褪色 | |
| B. | 石油裂化、煤的干馏、铝热反应都属于化学变化 | |
| C. | 蛋白质、纤维素、油脂、淀粉都是高分子化合物 | |
| D. | 乙烯常用作水果催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨基酸、淀粉均属于高分子化合物 | |
| B. | 乙醇不能发生取代反应 | |
| C. | 苯能使溴水褪色是因为发生了加成反应 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的pH值不变 | B. | 溶液中Na2CO3的物质的量不变 | ||
| C. | Na+与CO32-数目不变 | D. | Na2CO3溶液的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.请完成下列问题:
某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率和逆反应速率都增大,平衡向逆反应方向移动 | |
| B. | 正反应速率和逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
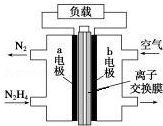 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列 关于该电池的叙述错误的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列 关于该电池的叙述错误的是( )| A. | b 极发生还原反应 | |
| B. | a 极的反应式为 N2H4-4e-═N2↑+4H+ | |
| C. | 放电时,电流从 b 极经过负载流向 a 极 | |
| D. | 其中的离子交换膜需选用阴离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com