
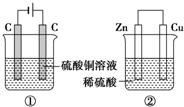
 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:分析 ①中加入19.6gCu(OH)2固体,n(Cu(OH)2)=$\frac{19.6g}{98g/mol}$=0.2mol,Cu(OH)2从组成上可看成CuO•H2O,加入0.2mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.2 mol H2SO4,并消耗0.2mol H2O,由电解的总反应式为:2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ 可知电解过程中共转移电子为0.8mol;②为原电池装置,Zn为负极,发生Zn-2e-=Zn2+,Cu为正极,发生2H++2e-=H2↑,以此解答该题.
解答 解:①中加入19.6gCu(OH)2固体,n(Cu(OH)2)=$\frac{19.6g}{98g/mol}$=0.2mol,Cu(OH)2从组成上可看成CuO•H2O,加入0.2mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.2 mol H2SO4,并消耗0.2mol H2O,由电解的总反应式为:2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ 可知电解过程中共转移电子为0.8mol,
(1)由2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 可知,电解生成0.2 mol H2SO4,同时生成0.1molO2,电解0.2mol H2O,生成0.3mol气体,则体积为(0.1+0.3)mol×22.4L/mol=8.96L,故答案为:8.96;
(2)①由2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 可知生成0.2molCu,则阴极质量增加0.2mol×64g/mool=12.8g,故答案为:12.8;
②两个装置,工作时转移的电子数相等,即转移0.8mol电子,则消耗0.4molZn,质量为0.4mol×65g/mol=26g,故答案为:26;
(3)①中阴极发生Cu2++2e-=Cu,总反应离子方程式为Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$Cu+2H++O2↑+H2↑,②中负极发生Zn-2e-=Zn2+,
故答案为:Cu2++2e-=Cu;2H++2e-=H2↑;Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$Cu+2H++O2↑+H2↑;Zn-2e-=Zn2+;
(4)①中电解生成了0.2 mol H2SO4,则c(H+)=0.4mol/L,pH=-lg0.4=-2×0.3+1=0.4,②中溶液及时硫酸不剩余,硫酸锌,溶液也呈酸性,最后pH小于7,
故答案为:0.4;小于;
(5)甲醛被氧化生成碳酸根离子,电极方程式为HCHO-4e-+6OH-=CO32-+4H2O,因转移0.8mol电子,则消耗0.2mol甲醛,分子数为0.2NA(或1.204×1023),
故答案为:HCHO-4e-+6OH-=CO32-+4H2O;0.2NA(或1.204×1023).
点评 本题是拼合型题目,涉及原电池、电解池等,题目综合性较大,难度较大,①中电子转移数目计算为易错点、难点,注意把握电极方程式的书写,为解答该题的关键,要求学生具有分析和解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②>③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最小 | |
| D. | 向溶液中加水稀释到原来的10倍,溶液的pH:④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 0.1mol•L-1Na2S溶液中所含S2-总数小于0.1NA | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
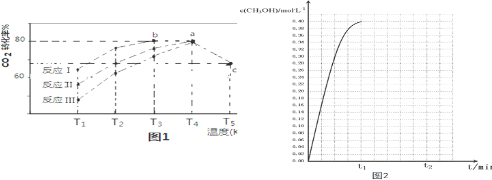
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.007 0 mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
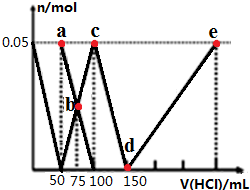
| A. | 原混合溶液中的n(CO32-):n(AlO2-)=1:1 | |
| B. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| C. | b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| D. | d→e的过程中水的电离程度逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com