
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。高.考.资.源.网
| [规格]每片含琥珀酸亚铁 [适应症]用于缺铁性贫血症,预防及治疗用。 [用量用法]成人预防量 小儿用量预防量 [贮藏]避光、密封、在干燥处保存。 |
(1) 该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用。
①实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应)。请写出该反应的离子方程式:
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
③某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)

(2) 称量上述含铁元素质量分数为20.00%的“速力菲”10.00 g ,将其全部溶于稀H2SO4中,配制成1000 ml溶液,取出20.00 ml,用0.01000 mol•L-1的KMnO4溶液滴定,用去KMnO4溶液12.00 ml ,该药品中Fe2+的氧化率为 。
(3) 已知琥珀酸为二元有机羧酸,含23.6 g 琥珀酸的溶液与4.0 mol•L-1 100.0 ml的氢氧化钠溶液恰好完全中和。核磁共振氢谱分析显示,琥珀酸分子谱图上只有两组吸收峰。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式)
。
科目:高中化学 来源: 题型:阅读理解

- 4 |
| 1000.00 mL |
| 20.00 mL |
| 10 g×20.00%-1.68 g |
| 10 g×20.00% |
| 1000.00 mL |
| 20.00 mL |
| 10 g×20.00%-1.68 g |
| 10 g×20.00% |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
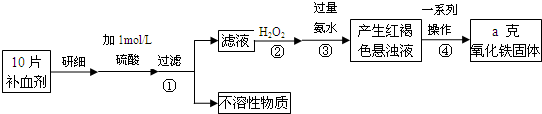
查看答案和解析>>
科目:高中化学 来源:广东模拟 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com