
| A、Na2SO4溶液 |
| B、NaOH 溶液 |
| C、CuCl2溶液 |
| D、H2SO4溶液 |


科目:高中化学 来源: 题型:
| A、使pH试纸呈红色的溶液中:I-、NO3-、SO42-、Na+ |
| B、水电离出的c(H+)=1×10-13mol/L的溶液中:CO32-、K+、ClO-、SO32- |
| C、在c(H+)/c(OH-)=1×1012的溶液中:NH4+、Ca2+、C1-、K+ |
| D、滴入KSCN溶液显血红色的溶液中:Na+ CO32- C6H5O- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
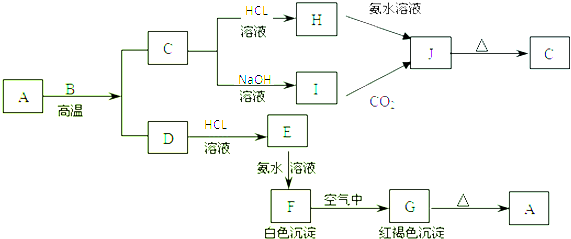
查看答案和解析>>
科目:高中化学 来源: 题型:
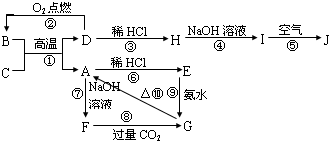 A~J分别表示中学化学中常见的一种物质,其中A为难熔的主族元素的氧化物,B为黑色晶体.它们之间的相互关系如右图所示:
A~J分别表示中学化学中常见的一种物质,其中A为难熔的主族元素的氧化物,B为黑色晶体.它们之间的相互关系如右图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LNH3中含有6.02×1022个N-H共价键 |
| B、100 mL 1 mol/L 的 Na2C03 溶液中含有 6.02×1022个 C032- |
| C、将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1.0mol/L |
| D、将7.8gNa202放入足量的水中,反应时转移6.02×1022个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |
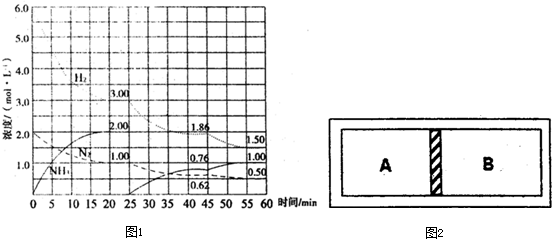
| 4 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
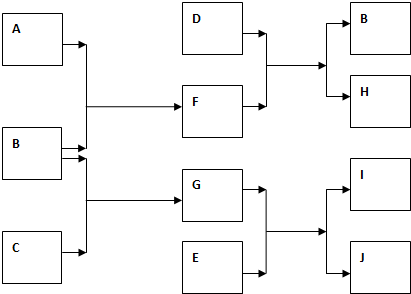
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中氢离子的浓度:c(H+)=1×10-9mol?L-1 |
| B、常温下,NH4Cl和NH3?H2O的混合溶液[pH=7,c(Cl-)=0.1 mol?L-1]中:c(Cl-)>c (NH4+)>c(H+)=c(OH-) |
| C、0.1 mol?L-1的氨水与0.05 mol?L-1 H2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(NH3)+c(NH3?H2O)=2c(SO42-) |
| D、浓度均为0.1mol?L-1的NH3?H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3?H2O)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com