

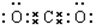 .
. 科目:高中化学 来源: 题型:实验题
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00mL 蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | T | Y | Z | W | M | N |
| 主要化合价 | +1 | -2 | -1 | +1 | +2 | +2、-2 | +7、-1 |
| 结构或用途 | 原子半径最小 | 地壳中含量最高的元素 | 非金属性最强 | 一种含氧化物可用作供氧剂 | 次外层电子数是最外层电子数的4倍 |
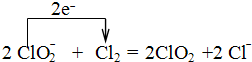 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 只含H、N、O三种元素的化合物,可能是离子化含物,也可能是共价化合物 | |
| B. | 元素周期表中,ⅠA族与ⅦA族元素间只能形成离子化合物 | |
| C. | NaHCO3、CH3COONa均含有离子键和共价键 | |
| D. | 化合物MgO、SiO2、SO3中化学键的类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③正确 | B. | 都不正确 | ||
| C. | ⑥⑦正确,其它不正确 | D. | 仅③正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取并收集干燥纯净的NH3 | B. |  模拟海水蒸馏 | ||
| C. | 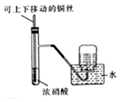 收集NO2气体 | D. |  包有足量Na2O2的脱脂面燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用热的浓盐酸除去试管内壁的MnO2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
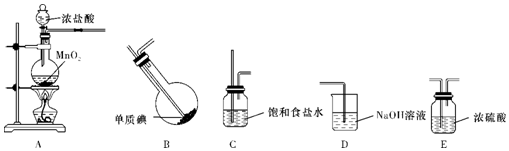
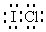 .A中反应的氧化剂和还原剂的物质的量之比为1:2.
.A中反应的氧化剂和还原剂的物质的量之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
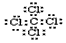 ,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.
,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com