

| A. | 铜中含有大量的有机物,可采用灼烧的方法除去有机物 | |
| B. | 灼烧后含有少量铜的可能原因是该条件下铜无法被氧气氧化 | |
| C. | 通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、蒸发、冷却结晶、过滤、自然干燥 | |
| D. | 与途径II相比,产生等量的胆矾途径I消耗硫酸少,途径I不会产生污染大气的气体 |
分析 杂铜通过一定方法得到粗CuO,粗CuO和浓硫酸在加热条件下反应生成硫酸铜和水,粗铜中的Cu也能和浓硫酸反应生成硫酸铜,将粗铜溶于稀硫酸,加热并通入氧气,CuO能和稀硫酸反应生成硫酸铜,Cu、稀硫酸、氧气也能反应生成硫酸铜,将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、干燥得到五水硫酸铜晶体,
A.有机物能燃烧生成气体;
B.灼烧过程中可能部分Cu不能被氧气氧化导致得到的粗铜中含有Cu;
C.从粗铜制取五水硫酸铜,应该向将Cu转化为硫酸铜,然后再从溶液中获取五水硫酸铜晶体;
D.I中加热条件下,浓硫酸和Cu反应生成二氧化硫,II中没有二氧化硫产生.
解答 解:杂铜通过一定方法得到粗CuO,粗CuO和浓硫酸在加热条件下反应生成硫酸铜和水,粗铜中的Cu也能和浓硫酸反应生成硫酸铜,将粗铜溶于稀硫酸,加热并通入氧气,CuO能和稀硫酸反应生成硫酸铜,Cu、稀硫酸、氧气也能反应生成硫酸铜,将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、干燥得到五水硫酸铜晶体,
A.有机物能燃烧生成气体,所以可以采用灼烧的方法除去有机物,故A正确;
B.灼烧过程中可能部分Cu不能被氧气氧化导致得到的粗铜中含有Cu,所以得到的粗氧化铜中含有Cu,故B正确;
C.从粗铜制取五水硫酸铜,应该向将Cu转化为硫酸铜,然后再从溶液中获取五水硫酸铜晶体,其操作步骤是酸溶、加热通氧气、过滤、蒸发、冷却结晶、过滤、自然干燥,故C正确;
D.I中加热条件下,浓硫酸和Cu反应生成二氧化硫,II中没有二氧化硫产生,所以I产生污染、II不产生污染,故D错误;
故选D.
点评 本题考查物质分离和提纯及物质制备,为高频考点,明确实验原理、基本实验操作方法、物质性质是解本题关键,注意:稀硫酸和Cu不反应,但在加热、通入氧气条件下,稀硫酸和Cu反应生成硫酸铜.


科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究Na与水反应可能有O2生成 | |
| B. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| C. | 探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能含有CuS | |
| D. | 探究向滴有酚酞的NaOH溶液中通入Cl2,溶液红色褪去的原因是溶液酸碱性改变所致,还是HClO的漂白性所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
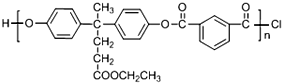
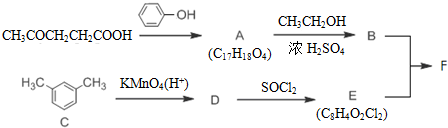
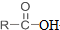 +SOCl2→
+SOCl2→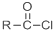 +SO2+HCl
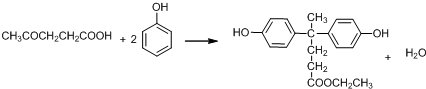
+SO2+HCl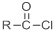 +R′OH→
+R′OH→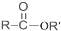 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)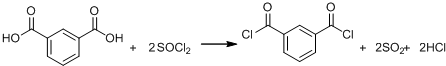 .
. .
.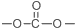 结构.
结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O3 | C. | NO2 | D. | N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该铅蓄电池正在充电 | |
| B. | 工作一段时间后,溶液的pH不断减小 | |
| C. | a为铅蓄电池的正极 | |
| D. | b电极发生的反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 | |
| B. | 纤维素、PLA(聚乳酸)、维生素C、硝化纤维等都是高分子化合物 | |
| C. | 高容量的储氢材料的研制是推广应用燃料电池的关键问题之一 | |
| D. | 将呼吸产生的二氧化碳用石灰水吸收符合”低碳经济“原则 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极 被还原 | B. | 正极 被氧化 | C. | 负极 被还原 | D. | 负极 被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com