
| 干法 | Fe2O3、KNO3、KOH 混合加热共熔生成紫红色 K2FeO4 和 KNO2 等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3和 KClO 反应生成紫红色 K2FeO4溶液 |

分析 干法Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等,反应为Fe2O3+3KNO3+4KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2FeO4+3KNO2+2H2O,
湿法制备高铁酸钾:KOH 与 Cl2 反应:2KOH+Cl2=KClO+KCl+H2O,溶液I含有KClO、KCl,向其中加入KOH固体,为下一步反应提供碱性的环境、与溶液 I 中过量的 Cl2 继续反应,生成更多的KClO,除去KCl,得到碱性的KClO浓溶液,加入90%的硝酸铁溶液,发生反应:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,将溶液蒸发浓缩,冷却结晶,过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的杂质,得到纯产品高铁酸钾,据此分析解答.
解答 解:(1)K2FeO4 中钾元素+1价,氧元素-2价,化合物中化合价代数和为0,则铁元素+6价;干法制备中由强碱KOH,故选用铁坩埚;
故答案为:+6;B;
(2)在温度较高时 KOH 与 Cl2 反应生成的是 KClO3,化学方程式为:6KOH+3Cl2$\frac{\underline{\;高温\;}}{\;}$KClO3+5KCl+3H2O;
故答案为:6KOH+3Cl2$\frac{\underline{\;高温\;}}{\;}$KClO3+5KCl+3H2O;
(3)在溶液 I 中加入 KOH 固体的目的是为下一步反应提供碱性的环境、与溶液 I 中过量的 Cl2 继续反应,生成更多的KClO;
故答案为:BD;
(4)向次氯酸钾强碱浓溶液中加入 90%的 Fe(NO3)3,发生反应的离子方程式为:Fe3++3OH+═Fe(OH)3、3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
(5)异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的杂质,且产品易干燥;
故答案为:减少K2FeO4 晶体洗涤时产品的损失且产品易干燥;
(6)K2FeO4 晶体表面附着氯离子,检验其洗涤液中是否含有氯离子即可,方法为:取少量最后一次的洗涤液于试管中,加入硝酸银溶液,无白色沉淀则已被洗净;
故答案为:取少量最后一次的洗涤液于试管中,加入硝酸银溶液,无白色沉淀则已被洗净;
(7)高铁酸钾(K2FeO4)作为水处理剂的优点之一是生成的氢氧化铁胶体能除去悬浮杂质,离子方程式为:4FeO42-+10H2O═4Fe(OH)(胶体)+3O2↑+8OH-;
故答案为:4FeO42-+10;4;3;8OH-.
点评 本题考查物质制备,为高频考点,涉及原氧化还原反应、盐类水解等知识点,明确反应原理及物质性质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 5g H2 和 5g O2 | B. | 标况下 5.6L N2和 22g CO2 | ||
| C. | 32 g SO2和0.5molH2 | D. | 44.8 L CO和2NA个O3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是两种或两种以上的物质发生的反应都属于化合反应 | |
| B. | 在反应中,不一定所有元素的化合价都发生变化 | |
| C. | 一种元素被氧化,一定有另一种元素被还原 | |
| D. | 物质只有和氧气发生反应才是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 nmolCH3OH(g)、nmolH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
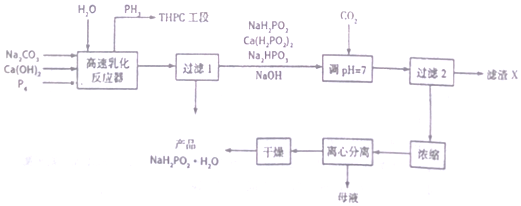
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
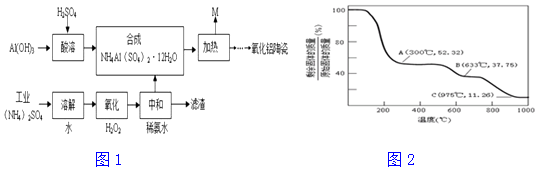
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①④⑥⑧ | C. | ①④⑥⑨ | D. | ①④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com